какой металл является самым активным
Активные металлы

Всего получено оценок: 900.
Всего получено оценок: 900.
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Самый активный металл на Земле
Наиболее активными металлами являются элементы I и II групп, находящиеся с левой стороны периодической таблицы Менделеева. Металл считается активным, когда он сильно и быстро реагирует с другими элементами.Реакционная способность металла возрастает по мере того, как мы переходим от верхней к нижней части периодической таблицы.
Исключением является водород, который не считается металлом и размещен в верхнем левом углу периодической системы химических элементов Менделеева.
По реакционной способности металлических элементов, перечисленных в периодической таблице химических элементов, они подразделяются на три группы:
Наиболее активные металлы на Земле — литий, цезий и франций.
Цезий — самым активный из нерадиоактивных элементов. Это редкий серебристо-желтый блестящий металл с атомным числом (число протонов в ядре) 55. Это очень мягкий элемент, который будет таять в ваших руках — если не взорвется раньше, так как он сильно реагирует на влагу.
Существует также очень радиоактивный элемент, франций, который может быть более активным, чем цезий. Или не может, мы, вероятно, никогда этого не узнаем, потому что франций не только крайне радиоактивный, но и крайне редкий металл.
Последний из тройки наиболее активных металлов — литий — обладает интересным свойством. Он придает малиновый цвет языкам пламени.
Вот видео-демонстрация активности лития, натрия, калия, рубидия и цезия.
Что такое цезий
Цезий относится к щелочным металлам. Они очень реакционноспособны, и не встречаются свободно в природе. Эти металлы также очень пластичные, они хорошие тепловые и электрические проводники.
Цезий был первым элементом, который можно было обнаружить со спектроскопом. В 1860 году его открыли немецкие химики Роберт Бунзен и Густав Кирхгоф, когда анализировали спектр минеральной воды из Бад-Дюркхаймского источника.
Цезий встречается естественным образом в минералах поллуцита и лепидолита. Также он содержится во многих алюмосиликатах, таких как берилл, петалит и карналлит. Самое богатое из известных месторождений цезия находится в Канаде, на берегу озера Берник-Лейк. Там сосредоточено около 70% всех земных запасов. Любопытно, что это озеро является местом проведения ежегодного фестиваля цезия (24 февраля), когда в снегу сжигаются тонны этого вещества, и преобладает другое цезиевое безумие.
А еще цезий является побочным продуктом ядерного деления в реакторах.
Свойства цезия
Пусть цезий и не самый тяжелый металл в мире, зато он самый активный и обладает рядом уникальных свойств:
Люди и животные постоянно подвергаются воздействию минимального количеств цезия при еде, дыхании и питье. Хотя маловероятно, что мы будем болеть только из-за цезия, его длительное воздействие может привести к неблагоприятным последствиям для здоровья, включая тошноту, рвоту, кровотечение и повреждение клеток.
Цезий и лечение рака
В настоящее время исследуется эффективность цезия для лечения нескольких форм рака, включая опухоли головного мозга. Цезий-131, радиоактивный изотоп цезия, вместе с другим радиоактивным изотопом (йодом-125) помещают в брахитерапевтическую капсулу («семя»).
По данным Американского общества брахитерапии, брахитерапевтическая капсула является радиоактивным «стручком», который помещается непосредственно в раковую ткань. Такие семена эффективны при нескольких формах рака, включая рак простаты, шейки матки и эндометрия.
В одном из исследований группе из 24 пациентов с опухолями головного мозга были имплантированы в опухоль брахиотерапевтические семена с цезием-131. Были отмечены минимальные побочные эффекты, но в целом пациенты хорошо перенесли эту форму лечения.
Идея использования семян брахитерапии с цезием-131 в качестве лечения рака возникла еще в 1960-х годах и была описана в исследовании, опубликованном в журнале « Радиология». В исследовании, опубликованном в журнале Medical Physics, в 2009 году обсуждалось использование семян цезия-131 для лечения рака предстательной железы с положительными результатами.
Необходимо больше исследований, прежде чем лечение цезием прочно займет свое место в медицине. Однако пока что исследования доказывают, что использование цезия-131 для лечения раковых опухолей при помощи брахиотерапии является обнадеживающим.
Сравнение цезия и франция
Как и цезий, франций (Fr) относится к щелочным металлам (только радиоактивным) и обладает крайне высокой химической активностью.
То есть по своим свойствам два самых активных металла на планете очень схожи.
Сравнения цезия и лития
Литий входит в топ-3 самых активных металлов на планете. Это ключевой компонент в батареях, которые питают смартфоны, ноутбуки и электромобили. Более половины поставок лития в мире идет из «литиевого треугольника» — Боливии, Чили и Аргентины. Крупнейший источник по получению лития из соли — это чилийская пустыня Атакама.
Активные металлы – список в химии, таблица ряда
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
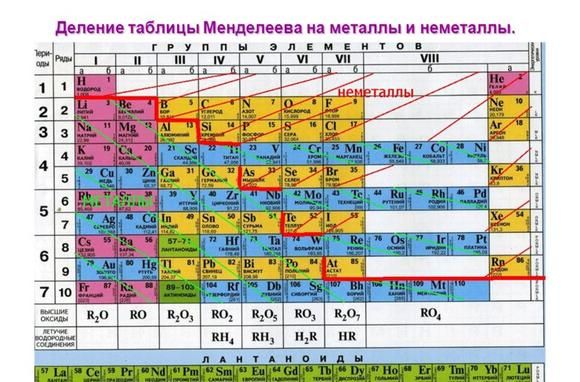
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
– Ca + Br2 → CaBr2;
– 2Al + 3S → Al2S3
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
– 2Na + 2H2O → 2NaOH + H2;
– Ca + 2H2O → Ca(OH)2 + H2
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
– Ca + 2HCl → CaCl2 + H2;
– 2K + 2HMnO4 → 2KMnO4 + H2
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
– 2Na + 2H2O → 2NaOH + H2;
– 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Активные металлы
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:

В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Рис. 3. Минералы и чистые металлы.
Тест по теме
Чтобы попасть сюда — пройдите тест.
Самый активный металл
С точностью ответить на вопрос, какой самый активный металл, почти невозможно. Все связано с тем, что ученые имеют разные точки зрения в отношении данного вопроса. Некоторые признают наиболее активным цезий. Другие утверждают, что таковым можно считать литий, а третьи утверждают, что наиболее активным считается франций. Почему же столько разных мнений и с чем это связано? Но при рассмотрении данного вопроса, учитывая все нюансы, можно найти более-менее ясный ответ, какой же металл может считаться наиболее активным.
Цезий
Если рассматривать просто активный элемент, то лидером среди таковых считается цезий. Известно, что в таблице Менделеева такой параметр, как активность, имеет свойство увеличиваться по направлению справа налево и сверху вниз. В находящихся в правой группе элементах на внешнем слое располагается 1 электрон, от которого атом избавляется довольно просто. Если бы электронов присутствовало 2 (как у веществ из второй группы), то отделение электронов занимало бы еще больше времени (и так дальше). Однако и в первой группе элементы являются по своей активности совершенно не одинаковыми. Чем в более нижней строчке располагается вещество, тем на более далеком расстоянии от ядра вращается электрон, а, следовательно, оторваться от ядра ему проще. Данным приведенным условиям полностью соответствует такой металл, как цезий. Именно поэтому его и можно отнести к наиболее активным.
Цезий открыт методом спектрального анализа (в 1860г.). За ярко-голубую полосу на спектроскопе металл назвали «цезием» («небесно-голубой» в переводе с латинского). Металл обладает наибольшей химической активностью, мгновенно окисляется на воздухе, возгорая при этом, а также реагирует с водой с образованием взрыва. Из-за своих свойств цезий применяют во многих отраслях промышленности и науки. Однако применение его очень избирательно, поскольку металл является дорогостоящим из-за затратности его добычи.
Литий
При внесении уточнений и рассмотрения наиболее электрохимически активного элемента становится очевидно, что лидирующее положение в плане активности займет литий. Название данного элемента переводится как «камень» – связано это с тем, что он был обнаружен в петалите (минерал). Металл, обладающий серебристым цветом, тонет в воде, но уверенно держится на поверхности керосина. По электрохимической активности данный элемент превосходит все остальные щелочные элементы, вытесняя другие металлы при химических реакциях. Это главное свойство лития является определяющим для остальных его характеристик.
Литий является очень важным элементом для нормального функционирования всего организма человека, но необходим он в маленьких дозах. При повышенной концентрации лития в организме человека может произойти отравление, пониженное же его содержание может привести к психической нестабильности человека. В некоторых напитках литий даже позиционировался, как превосходное средство от похмельного синдрома. Возможно, это не лишено смысла, и литий действительно помогает справиться с недомоганием после принятия спиртных напитков, однако употреблять его в повышенных дозах не рекомендуется в силу вышеуказанных причин.
Франций
И франций может уверенно претендовать на звание наиболее активного элемента. При этом он схож по своим характеристикам с цезием. Поэтому эти два металла могут вполне конкурировать между собой за звание наиболее активных. В природе франций содержится в ограниченных количествах. Долгое время даже не удавалось отыскать этот элемент, несмотря на то, что он был давно предсказан, а его свойства хорошо описаны. Из-за высокой радиоактивности франций отличается нестабильностью.
В далекие времена французские алхимики имели огромное желание получать золото из других элементов. Однако была выявлена другая возможность – золото отлично подходит для выделения из него франция. Однако таким методом получить франций в больших количествах очень сложно. Итак, данный металл является одним из наиболее активных, в значительной степени превосходящих самый активный неметалл, которым является фтор.