какой механизм лежит в основе синтеза эйкозаноидов
30. Строение, механизм синтеза и биологическая роль эйкозаноидов.
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.
Дальнейшие превращения PG Н2 специфичны для каждого типа клеток. Например, PG Н2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG Е2 или под действием PG D синтазы с образованием PG D2.
31. Биохимическая роль вторичных мессенджеров при передаче гормонального сигнала.
Концентрация вторичных посредников в цитозоле может быть повышена различными путями: активацией ферментов, которые их синтезируют, как, например в случае активации циклаз, образующих циклические формы нуклеотидов (цАМФ, цГМФ), либо путем открывания ионных каналов, позволяющих потоку ионов металлов, например, ионов кальция войти в клетку. Эти малые молекулы могут далее связывать и активировать эффекторные молекулы — протеинкиназы, ионные каналы и разнообразные другие белки.
Механизм действия. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α) и ионных каналов. В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.
Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме (до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов, вторичных мессенджеров (ИФ3 и цАМФ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера.
Действие кальция опосредовано специальными Са2+-связывающими белками, к которым принадлежат аннексин, кальмодулин и тропонин. Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са2+ кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
30. Строение, механизм синтеза и биологическая роль эйкозаноидов.
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.
Дальнейшие превращения PG Н2 специфичны для каждого типа клеток. Например, PG Н2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG Е2 или под действием PG D синтазы с образованием PG D2.
31. Биохимическая роль вторичных мессенджеров при передаче гормонального сигнала.
Концентрация вторичных посредников в цитозоле может быть повышена различными путями: активацией ферментов, которые их синтезируют, как, например в случае активации циклаз, образующих циклические формы нуклеотидов (цАМФ, цГМФ), либо путем открывания ионных каналов, позволяющих потоку ионов металлов, например, ионов кальция войти в клетку. Эти малые молекулы могут далее связывать и активировать эффекторные молекулы — протеинкиназы, ионные каналы и разнообразные другие белки.
Механизм действия. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α) и ионных каналов. В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.
Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме (до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов, вторичных мессенджеров (ИФ3 и цАМФ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера.
Действие кальция опосредовано специальными Са2+-связывающими белками, к которым принадлежат аннексин, кальмодулин и тропонин. Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са2+ кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
ЭЙКОЗАНОИДЫ
Эйкозаноиды – обширная группа физиологически и фармакологически активных соединений. К ним относятся простаноиды (простагландины, простациклины, тромбоксаны) и лейкотриены.
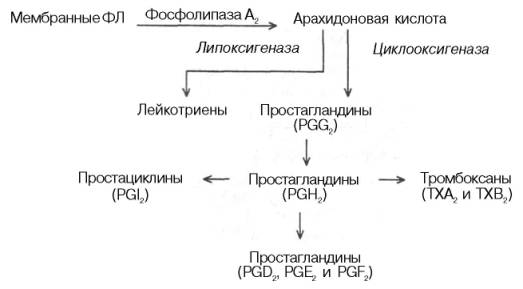
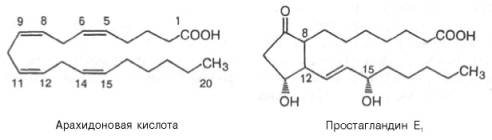
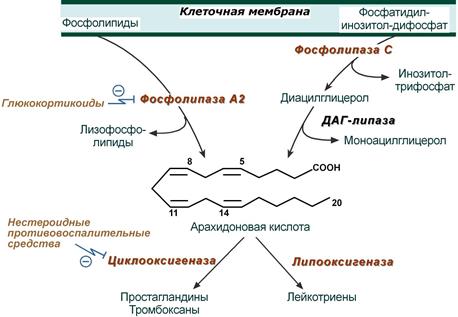
Наиболее активным предшественником эйкозаноидов является входящая в состав фосфолипидов плазматических мембран арахидоновая кислота. Последняя освобождается из фосфолипидного бислоя мембраны при действии фосфолипазы А2. В образовании эйкозаноидов принимают участие также и другие незаменимые жирные кислоты (линолевая и α-лино-леновая), но только после элонгации на два углеродных атома и десату-рации, т.е. после превращения в 20-углеродные тетраеновые кислоты. Поэтому эйкозаноиды можно разделить на 3 группы (в каждую входят простагландины, тромбоксаны и лейкотриены) в зависимости от предшественников: линолеата, арахидоната и линолената.
Рис. 11.5. Участие арахидоновой кислоты в образовании эйкозаноидов (по А.Н. Климову и Н.Г. Никульчевой).
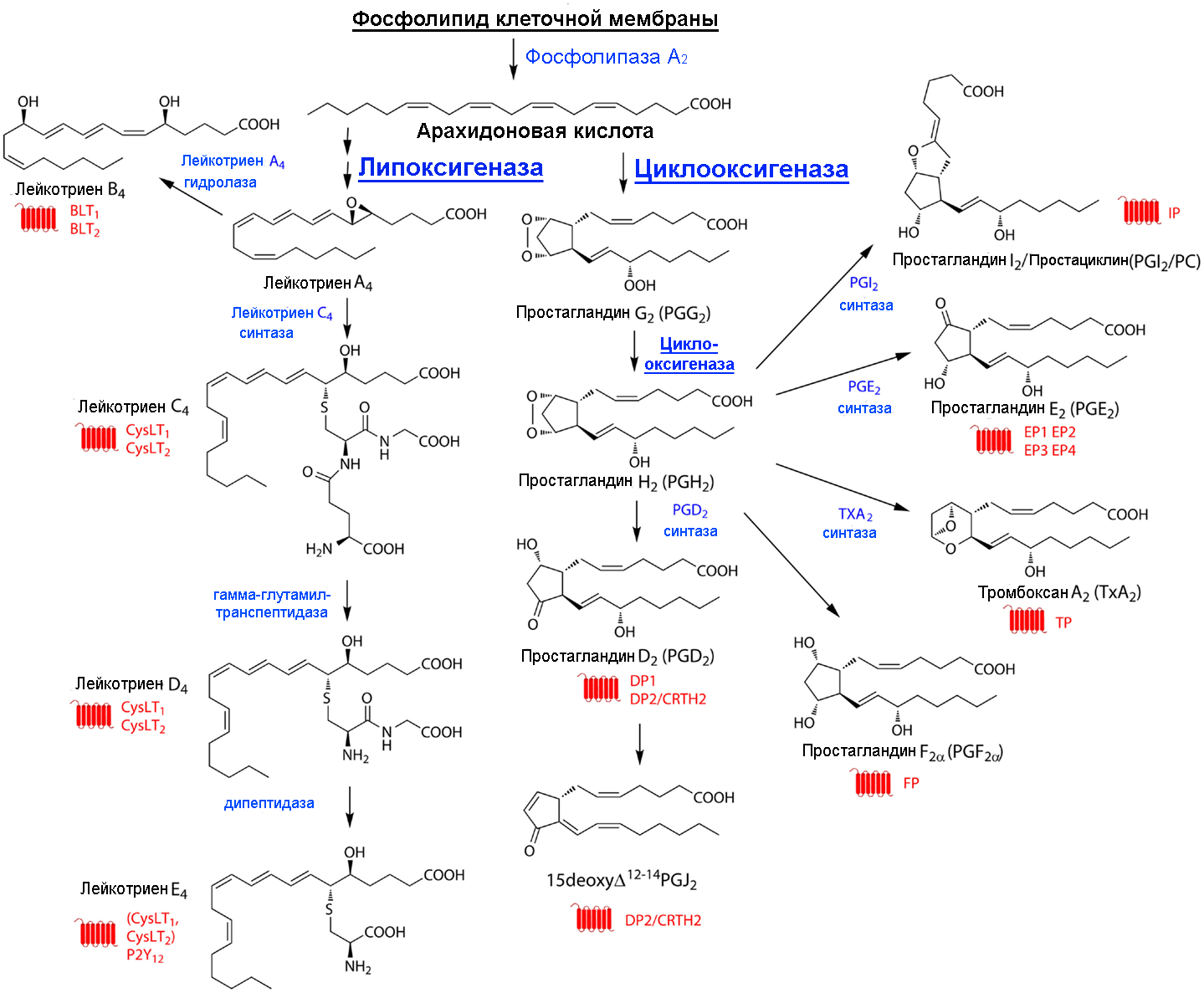
Пути метаболизма арахидоната (субстрата) различны, причем синтез простаноидов конкурирует за субстрат с синтезом лейкотриенов. Эти два пути называют соответственно циклооксигеназным и липоксигеназным (рис. 11.5).
Простагландины (ПГ, Pg). По существу ПГ представляют собой 20-углеродные жирные кислоты, содержащие 5-углеродное кольцо и гидро-кси- и/или кетогруппы:
Обнаружено шесть первичных природных ПГ, три из них серии Е (ether-soluble) и три – серии F (phosphate-soluble). ПГ серии Е содержат в положении 9 кетогруппу, а ПГ серии F – гидроксигруппу. Имеется также несколько вторичных ПГ, представляющих собой продукты энзиматическо-го превращения первичных.
ПГ проявляют свое действие в чрезвычайно низких концентрациях (1– 10 нг/мл). Будучи введенными в организм, они вызывают сокращение гладкой мускулатуры, регулируют приток крови к определенному органу, оказывают переменчивое влияние на кровяное давление, контролируют транспорт ионов через мембраны и т.д.
В целом ПГ, не являясь гормонами, модулируют действие последних. Они преимущественно влияют на физиологические функции тех клеток, в которых синтезируются. Характер воздействия ПГ зависит от типа клетки, и этим ПГ отличаются от гормонов с их однозначным эффектом.
ПГ могут использоваться как терапевтическое средство для предотвращения оплодотворения, стимулирования нормальных родов, прерывания беременности, предупреждения развития или обезболивания язвы желудка, лечения воспалительных процессов и регуляции кровяного давления, а также для снятия приступов астмы и др.
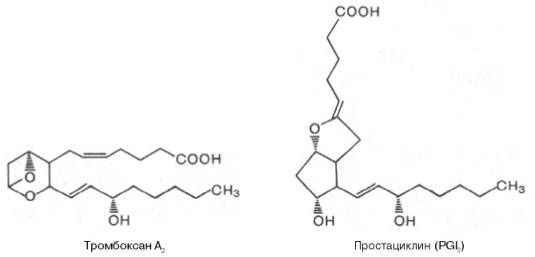
Среди продуктов эндопероксидации вторичных ПГ необходимо отметить тромбоксаны и простациклины. Тромбоксаны образуются в тромбоцитах и после выхода в кровяное русло вызывают сужение кровеносных сосудов и агрегацию тромбоцитов.
Простациклины образуются в стенках кровеносных сосудов и являются сильными ингибиторами агрегации тромбоцитов. Таким образом, тромбо-ксаны и простациклины выступают как антагонисты. Поэтому соотношение тромбоксана и простациклина во многом определяет условия тромбообра-зования на поверхности эндотелия сосудов. Приводим формулы двух важнейших представителей этих соединений:
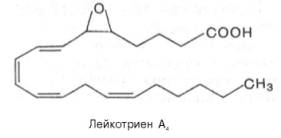
Лейкотриены. Это производные 20-углеродных полиненасыщенных (эй-козановых) кислот. Название «лейкотриены» происходит от двух слов: «лейкоциты» (впервые эти соединения были обнаружены в лейкоцитах) и «триены» (у всех представителей этого класса соединений из четырех ненасыщенных связей три являются конъюгированными). Лейкотриены синтезируются из эйкозановых кислот в лейкоцитах, клетках мастоцитомы, тромбоцитах и макрофагах по липоксигеназному пути в ответ на иммунологические и неиммунологические стимулы. Приводим структуру одного из лейкотриенов:
Лейкотриены прежде всего рассматриваются как медиаторы воспалительных реакций; они вызывают сокращение мышечной ткани бронхов в концентрациях, в 100–1000 раз меньших, чем гистамин; способствуют сокращению коронарных сосудов. В целом функция лейкотриенов в норме и при патологии во многом еще неясна.
У эйкозаноидов широкие возможности
К эйкозаноидам (είκοσι, греч.-двадцать) относят окисленные производные эйкозановых кислот: эйкозотриеновой (С20:3), арахидоновой (С20:4), тимнодоновой (С20:5) жирных кислот. Активность эйкозаноидов значительно разнится от числа двойных связей в молекуле, которое зависит от строения исходной жирной кислоты.
Простагландины (Pg) синтезируются практически во всех клетках, кроме эритроцитов и лимфоцитов. Выделяют типы простагландинов A, B, C, D, E, F. Функции простагландинов сводятся к изменению тонуса гладких мышц бронхов, мочеполовой и сосудистой системы, желудочно-кишечного тракта, при этом направленность изменений различна в зависимости от типа простагландинов, типа клетки и условий. Они также влияют на температуру тела.
Простациклины являются подвидом простагландинов (Pg I), вызывают дилатацию мелких сосудов, но еще обладают особой функцией – ингибируют агрегацию тромбоцитов. Их активность возрастает при увеличении числа двойных связей в исходных жирных кислотах. Синтезируются в эндотелии сосудов миокарда, матки, слизистой желудка.
Тромбоксаны (Tx) образуются в тромбоцитах, стимулируют их агрегацию и вызывают сужение сосудов. Их активность снижается при увеличении числа двойных связей в исходных жирных кислотах.
Лейкотриены (Lt) синтезируются в лейкоцитах, в клетках легких, селезенки, мозга, сердца. Выделяют 6 типов лейкотриенов A, B, C, D, E, F. В лейкоцитах они стимулируют подвижность, хемотаксис и миграцию клеток в очаг воспаления, в целом они активируют реакции воспаления, предотвращая его хронизацию. Также вызывают сокращение мускулатуры бронхов (в дозах в 100-1000 раз меньших, чем гистамин).
Депонироваться эйкозаноиды не могут, разрушаются в течение нескольких секунд, и поэтому клетка должна синтезировать их постоянно из поступающих жирных кислот ω6- и ω3-ряда.
Синтез эйкозаноидов
Под влиянием гистамина, комплекса антиген-антитело, цитокинов, кининов активируются фосфолипаза А2 или комбинация фосфолипазы С и ДАГ-липазы, которые отщепляют жирную кислоту из положения С2 мембранных фосфолипидов.
Синтез эйкозаноидов на примере арахидоновой кислоты.
Химизм реакций циклооксигеназы и липоксигеназы показан здесь.
Лекарственная регуляция синтеза
Гормоны коры надпочечников глюкокортикоиды опосредованно, через синтез специфических белков, подавляют активность фосфолипазы А2 и, следовательно, образование всех типов эйкозаноидов. На этом основано широкое использование препаратов кортизола (преднизолон, дексаметазон) для лечения воспалительных, аутоиммунных и аллергических состояний.
Нестероидные противовоспалительные средства (аспирин, индометацин, ибупрофен) ингибируют циклооксигеназу и снижают выработку простагландинов и тромбоксанов. Они нашли применение как противовоспалительные, жаропонижающие и анальгезирующие средства, и в кардиологии для профилактики тромбозов (аспирин).
Блокирование циклооксигеназы в почках, как побочный эффект салицилатов, вызывает уменьшение синтеза простагландинов в почечных сосудах и снижение кровообращения в почках.
В зависимости от исходной жирной кислоты и, соответственно, числа двойных связей все эйкозаноиды делят на три группы:
Первая группа – синтезируется из эйкозотриеновой кислоты (С20:3), которая образуется из линоленовой (С18:3). В соответствии с количеством двойных связей простагландинам и тромбоксанам присваивается индекс 1, лейкотриенам – индекс 3: например, Pg E1, Pg I1, Tx A1, Lt A3.
Интересно, что PgE1 ингибирует аденилатциклазу в жировой ткани и препятствует липолизу, также он участвует в патогенезе бронхоспазма.
Вторая группа синтезируется из арахидоновой кислоты (С20:4). По тому же правилу ей присваивается индекс 2 или 4, например, Pg E2, Pg I2, Tx A2, Lt A4.
Третья группа эйкозаноидов происходит из тимнодоновой кислоты (С20:5). По числу двойных связей присваиваются индексы 3 или 5: например, Pg E3, Pg I3, Tx A3, Lt A5.
Подразделение эйкозаноидов на группы имеет клиническое значение. Особенно ярко это проявляется на примере простациклинов и тромбоксанов:
| Исходная жирная кислота | Число двойных связей в молекуле | Активность простациклинов | Активность тромбоксанов |
| Линоленовая, С18:3 | 1 |  |  |
| Арахидоновая, С20:4 | 2 | ||
| Тимнодоновая, С20:5 | 3 |
По следам оксилипинов: эволюция биохимического «эсперанто»
По следам оксилипинов: эволюция биохимического «эсперанто»
Художественная интерпретация филогенетического дерева липоксигеназ как эволюционного «фейерверка». Скорее всего, первая древняя бактерия, запустившая этот фейерверк, могла образовывать многоклеточные структуры и использовала липоксигеназы для синтеза межклеточных химических сигналов. В большинстве современных бактериальных и эукариотических организмов эта функция сохранилась, но некоторые бактерии научились использовать липоксигеназы для вероломного нападения на другие организмы.
коллаж автора статьи
Авторы
Редакторы
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Оригинал статьи опубликован в журнале «Биохимия». Наш расширенный популярный пересказ статьи публикуется в рамках спецпроекта «Биохимия — Биомолекуле».
Ничто в биологии не имеет смысла,
кроме как в свете эволюции.
Ф. Добжанский
Эйкозаноиды животных: дирижеры воспаления
В человеческом организме, как и в организмах всех позвоночных, большинство клеток, за исключением эритроцитов, умеют синтезировать эйкозаноиды — производные жирных кислот, к которым присоединена какая-либо содержащая кислород группа атомов. И, если опустить многочисленные частности и не перечислять всех функций, то основная их роль — координировать процесс воспаления. Синтез эйкозаноидов начинается при повреждении клетки — и на этот химический сигнал сбегаются лейкоциты, чтобы отбить атаку вероятного противника из мира бактерий. Впрочем, не все эйкозаноиды стимулируют воспаление — некоторые являются сигналом отбоя для лейкоцитов, чтобы ограничить защитную реакцию и не позволить ей самой уничтожить поврежденную ткань.
Синтез эйкозаноидов начинается с того, что фосфолипаза A2 расщепляет мембранные фосфолипиды, буквально «выдергивая» арахидоновую кислоту из мембраны клетки. Хорошей литературной аналогией будет сцена из романа Гектора Мало «Без семьи», где Виталис и Реми вытаскивали понемногу ветки из стенок шалаша, чтобы топить очаг. Вот и в клетке в «очаге» биосинтеза эйкозаноидов горят те же компоненты, что составляют оболочку клетки.
Рисунок 1. Биосинтез эйкозаноидов в организме человека с участием циклооксигеназы и липоксигеназы (ферменты системы цитохрома P450 не показаны)
Вырванную фосфолипазой арахидоновую кислоту может взять в обработку один из двух ферментов: липоксигеназа или циклооксигеназа. Есть еще ферменты системы цитохрома P450, но для упрощения сейчас говорить о них не будем — прибережем для другого раза.
Липоксигеназа катализирует, по сути, реакцию перекисного окисления липида — только в конкретном месте и с определенной стехиометрией (зависит от изофермента). Получается гидропероксид, который называется гидропероксиэйкозатетраеновой кислотой (HPETE). Такие гидропероксиды довольно неустойчивы и самопроизвольно превращаются в эпоксиды. Дальше целый набор ферментов берется за эти эпоксиды, превращая их в лейкотриены и липоксины. А еще часть гидропероксидных производных превращаются не в эпоксиды, а в гидроксиды — так формируются гидроксийэкозатетраеновые кислоты (HETE).
Второй фермент — циклооксигеназа — тоже катализирует перекисное окисление арахидоновой кислоты, только с замыканием ее молекулы в пятичленное кольцо. Так получаются простагландины.
Вся эта пестрая компания эйкозаноидов действует как паракринные медиаторы — то есть проявляет активность поблизости от места выделения. Основная их роль — дирижировать процессом воспаления. Мы не случайно употребляем именно это слово — они регулируют почти все стороны этой защитной реакции: движение лейкоцитов к месту повреждения, их активацию, повышение проницаемости мелких сосудов (чтобы лейкоциты могли выйти из них), свертывание крови. Среди эйкозаноидов есть стимуляторы воспалительного процесса (из упомянутых нами, например, лейкотриены и большинство простагландинов) и его супрессоры, ограничители (из упомянутых нами — липоксины). Эти эффекты широко используются в медицине для подавления воспалительных процессов: все, кто хоть раз принимал таблетку аспирина или ибупрофена, имеют опыт блокирования синтеза простагландинов циклооксигеназой. А для лечения астмы иногда используется блокирование липоксигеназы препаратом зилеутоном. Правда, в России он не зарегистрирован, поэтому у нас чаще с этой целью используются блокаторы рецепторов лейкотриенов (которые, как было упомянуто, являются продуктами липоксигеназного пути).
Всё это хорошо знакомо медикам и биологам, и может быть даже немного непонятно, зачем мы пересказываем здесь прописные истины. Но дело в том, что в других царствах живых организмов встречаются потрясающе похожие биологически активные вещества и ферменты.
Оксилипины растений: управляем стрессами
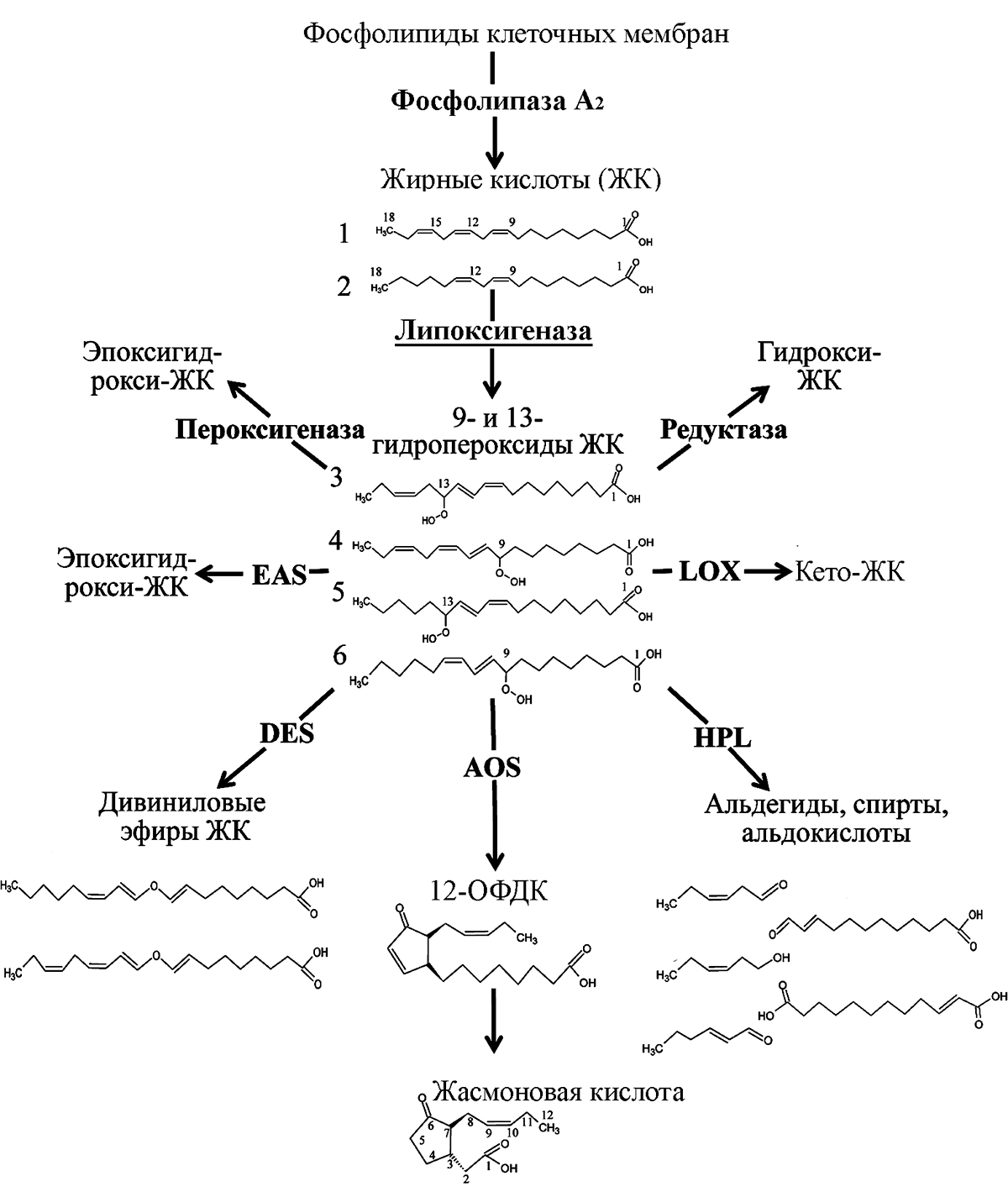
Мембраны растительных клеток не содержат арахидоновой кислоты [2]. Но похожая на нее линоленовая кислота используется растениями для биохимических превращений, очень похожих на наш биосинтез эйкозаноидов (рис. 2). Правда, название «эйкозаноиды» к метаболитам растений уже не применимо: оно происходит от древнегреческого εἴκοσι — «двадцать» — и относится только к производным жирных кислот с 20-углеродной цепью. Линоленовая кислота содержит только 18 атомов углерода, поэтому продукты ее перекисного окисления называются октадеканоидами — от древнегреческого слова ὀκτω(καί)δεκα — «восемнадцать». Чтобы лишний раз не путаться, вспоминая греческий термин, и подчеркнуть химическое сходство, такие продукты принято называть общим термином «оксилипины». Он и будет употребляться для аналогов эйкозаноидов всюду за пределами человеческого организма и организма позвоночных. Таким образом, наши эйкозаноиды — это просто 20-углеродные оксилипины. А октадеканоиды растений — 18-углеродные оксилипины.
Рисунок 2. Биосинтез оксилипинов у растений
[3], рисунок с изменениями
Итак, у растений линоленовая кислота, как наша арахидоновая, тоже может быть вырвана из мембранных фосфолипидов фосфолипазой A2. Дальше она может быть взята в обработку. теми же липоксигеназами. Конечно, «теми же» мы говорим весьма условно: мы имеем в виду, что растительные липоксигеназы являются гомологами животных и делают с линоленовой кислотой то же самое, что животные — с арахидоновой: синтезируют из нее гидропероксиды [4].
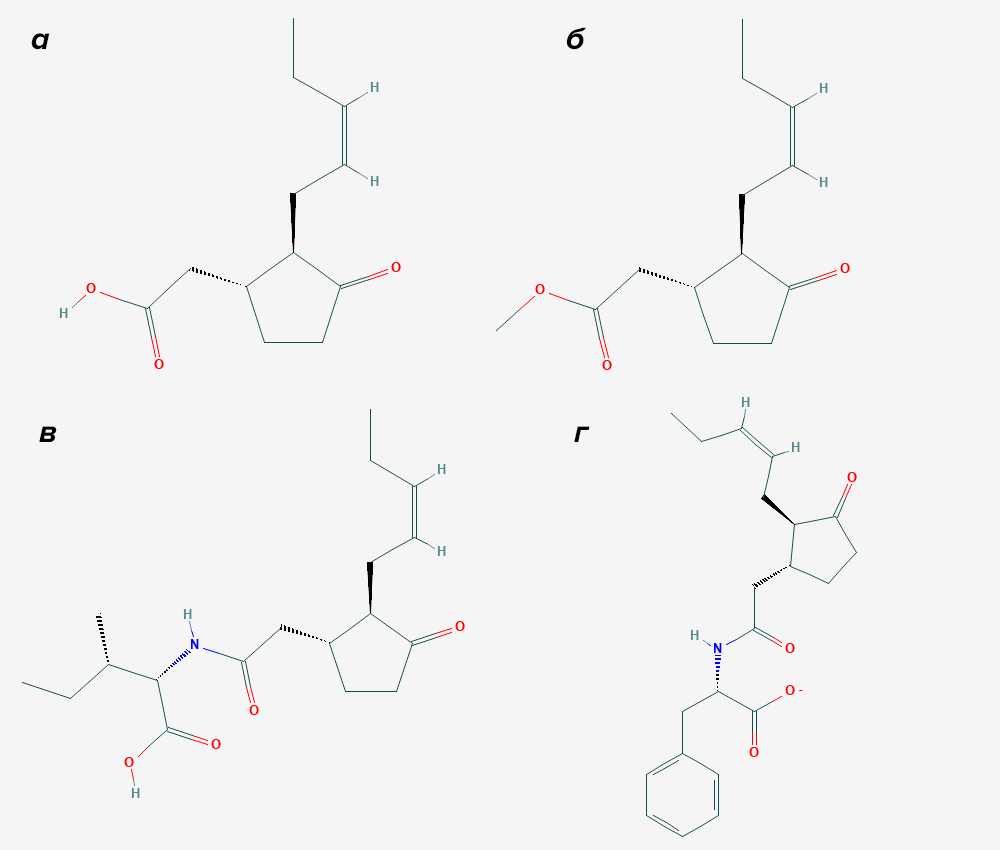
Здесь начинаются химические различия: два фермента сразу же подхватят часть гидропероксида и нарубят его на летучие спирты и альдегиды (мы так не умеем — все наши эйкозаноиды нелетучи). Та часть гидропероксида, которая избежит этой участи, будет взята в обработку ферментом алленоксидсинтазой, которая сделает из нее эпоксид, похожий на человеческий лейкотриен A4. А дальше этот эпоксид будет замкнут в пятичленное кольцо ферментом алленоксидциклазой с образованием соединения, похожего на простагландин — 12-оксофитодиеновой кислоты. Ее биохимическое отличие от простагландинов — в том, что у растений она в дальнейшем укорачивается с карбоксильного конца обычным бета-окислением (тем самым, которое позволяет всему живому миру получать энергию из жиров) [4]. В итоге получается жасмоновая кислота, названная так потому, что впервые была выделена из масла жасмина (рис. 3) в составе метилового эфира. Она и ее производные — эфиры, конъюгаты с аминокислотами, гликозиды — носят название жасмонатов (рис. 4). Химически их можно рассматривать как аналоги наших простагландинов — только синтезируются они у растений не по циклооксигеназному, а по липоксигеназному пути.
Рисунок 3. Жасмин крупноцветковый (Jasminum grandiflorum). Именно из него в 1962 году выделили один из гормонов жасмонатного ряда — метилжасмонат, — что дало название всей группе веществ [5].
Рисунок 4. Жасмонаты. а — Родоначальник жасмонатов — жасмоновая кислота, очень напоминающая укороченный простагландин. б — Метилжасмонат — метиловый эфир жасмоновой кислоты. в — Конъюгированный жасмонат — жасмоноил-изолейцин — один из самых мощных гормонов высших растений. г — Другой конъюгированный жасмонат — жасмоноил-фенилаланин.
Не вдаваясь в дальнейшие биохимические подробности, отметим, что по липоксигеназному пути у растений также синтезируются дивиниловые эфиры жирных кислот, эпоксидированные спирты и 12-оксододека-10-еновая кислота. Не надо пытаться это выговорить, мы сами называем ее «травматин». Почему «травматин»? Вот здесь пришло время перейти к самому интересному.
Некоторое биохимическое сходство между нашими и растительными оксилипинами мы уже увидели. Но на первый взгляд идея, что их функции тоже похожи, может показаться безумной: у растений же нет воспаления! Их клетки заключены в жесткие целлюлозные оболочки, что исключает для них всякую возможность примчаться на место повреждения и уничтожить патоген, как делают наши лейкоциты при воспалении. Но, если посмотреть шире, обнаружится фантастическое сходство. То, что медикам и даже неспециалистам известно под словом «воспаление» — это всего лишь стереотипная реакция на повреждение патогеном или каким-то физико-химическим фактором. Растения тоже реагируют на подобную ситуацию — хоть и не так, как мы. И как раз эти реакции координируются растительными оксилипинами.
Прежде всего, один компонент воспалительной реакции животных — регенерация поврежденных тканей — есть и у растений. Им и управляет травматин — он стимулирует деление клеток и заживление повреждения. Но мало заделать повреждения — надо дать отпор патогену. Растения успешно решают эту проблему — но химическим путем. Их возможности по части синтеза вторичных метаболитов — соединений, которые нужны не в самом метаболизме растения, а для каких-то экологических функций, — многократно превосходят наши. Например, против микробов растение может пустить в ход изопреноиды, терпеноиды, алкалоиды и стильбены [4], [6]. Все эти антимикробные агенты носят название «фитоалексины» (рис. 5). Из белков против непрошеного гостя будут применены дефензины (похожие на наши) и набор ферментов (глюканазы, хитиназы, протеазы), разрушающие его клеточные стенки [4], [6].
Рисунок 5. Некоторые примеры фитоалексинов: а — даниэлон; б — птеростильбен; в — капсидиол; г — аллицин — фитоалексин чеснока, который люди «заимствуют» у растений и используют в народной медицине.
Кроме того, растения имеют перед нами одно преимущество — они могут потерять почти любую часть тела и выжить. Если у тебя сто листов, от потери десяти из них ты сразу не погибнешь. Ситуация еще более упрощается, если ты можешь отращивать любые органы взамен утерянных (а не как эти млекопитающие, неспособные отрастить даже откушенный палец). В такой ситуации растения могут просто уничтожить инфицированную часть вместе с патогеном — ящерица с ее отбрасываемым хвостом, наверное, позавидовала бы. Так что, стоит бактерии или грибу вторгнуться в какую-нибудь часть растения, как растение включает реакцию сверхчувствительности — запрограммированную гибель клеток с массивной генерацией активных форм кислорода. Это увеличивает шансы, что и патоген сгорит в этом окислительном пожаре.
Так что иммунитет растений настолько сложен и интересен, что наши лейкоциты могут выглядеть блекло. Но мы же вроде говорили об оксилипинах? Да — ведь именно они (наряду с этиленом и салициловой кислотой) управляют иммунными реакциями у растений. Жасмонаты, окстфитодиеновая кислота, летучие альдегиды и спирты запускают в организме растений каскады иммунного ответа. И в этом состоит их кардинальное сходство с эйкозакоидами позвоночных — и у растений, и у животных оксилипины участвуют в иммунном ответе.
Удивительно, что рецепторы, через которые действуют эти соединения, у растений и животных разные. Эйкозаноиды животных действуют в основном через набор рецепторов, связанных с G-белком — простаноидные, лейкотриеновые, формилпептидные, резольвиновые и некоторые другие рецепторы (показаны красным цветом на рис. 1). Их гомологи не обнаружены у растений, и в принципе рецепторы оксилипинов у них мало охарактеризованы. Известно лишь, что рецептором для жасмонатов служит мультибелковый комплекс, включающий транскрипционный фактор COI1 (Coronatine Insensitive 1) [7]. В целом, картина получается довольно интересная: гомологичные ферменты, сходные медиаторы и реакции на них — но разные рецепторы.
Химическое сходство жасмонатов с нашими простагландинами настолько велико, что они могут связываться даже с одним из предназначенных для них рецепторов — гамма-рецептором, активируемым пролифераторами пероксисом (PPARγ). Об этом мы писали на «Биомолекуле» в своей статье «Жасмонаты: “слезы феникса” из растений» [24]. Мы описывали свое исследование, где предложили альтернативную гипотезу, по которой жасмонаты связываются с PPARγ немного по-другому. Однако в последнее время появляются новые данные, склоняющие к предположению, что дело здесь все-таки в сходстве с простагландинами. Сейчас мы планируем еще одно исследование с целью прояснить этот вопрос.
Больше того, у растений оксилипины — это часть ответа на стресс как таковой. При разговоре о стрессе у человека или животного на ум прежде всего приходит адреналин — гормон «борьбы и бегства». Но у растений такая реакция невозможна сама по себе, поэтому и отдельные гормоны для нее излишни. Правда, у них есть аналоги наших глюкокортикоидов — брассиностероиды, — которые тоже отвечают за стрессовые ответы. Но все же большое количество стрессовых реакций «берут на себя» оксилипины, координируя ответ растения на засуху, избыточную соленость, избыточный свет и другие невзгоды окружающей среды. Если у нас простагландины — это только медиаторы воспаления, то жасмонаты — их химические аналоги в растительном организме — настоящие гормоны стресса. Если описать их функции вкратце, то они переключают растение с режима роста на режим защиты [3]. В частности, они ингибируют фотосинтез и деление клеток, «притормаживая» все жизненные процессы растения, и задействуются в начале листопада перед долгой зимой. В частности, распад хлорофилла, который в сентябре и октябре обнажает красную, оранжевую и желтую палитру каротиноидов (рис. 6), обусловлен в том числе жасмонатами [3]. Если ты не можешь бороться и бежать, тебе остается впасть в аналог спячки и переждать неблагоприятные условия — вот такая фитогормональная философия. Помимо жасмонатов, «гормонами стресса» у растений являются оксофитодиеновая кислота, альдегиды и спирты [3].
Рисунок 6. Яркие краски «золотой осени» создаются растительными «гормонами стресса» — в том числе жасмонатами, дальними «родственниками» наших простагландинов
Растениям недоступна еще одна вещь, привычная для нас — общение словами и звуками. Если животное кто-то ест, оно может закричать и позвать на помощь (человек — также заплакать и выразить все словами). Но растения так не умеют. Эту проблему они решают. да, снова химическим путем, и роль «плача» у них выполняют те же оксилипины. Плач растений знаком всем, кто чувствовал запах свежескошенной травы — это запах тех самых альдегидов и спиртов, образующихся из жирных кислот при повреждении. Массивное повреждение растений при косьбе обеспечивает выделение этих ароматных летучих оксилипинов.
Конечно, растения «плачут» летучими оксилипинами не для того, чтобы разжалобить человека. Такая коммуникация нужна им в том числе для того, чтобы позвать на помощь другие виды. Например, наездников — естественных врагов личинок, поедающих листья [4]. Более того, один из жасмонатов — метилжасмонат (рис. 4б), он же метиловый эфир жасмоновой кислоты, — является летучим и способен передаваться по воздуху от растения к растению [8]. Это позволяет одному растению при повреждении инициировать защитные реакции «соседей» — заблаговременно. Если вдуматься, отличный способ коммуникации — передавать свои гормоны по воздуху. Хотя, наверное, наш способ на основе речи «круче».
Мхи, водоросли, грибы: парад оксилипинов
Здесь мы вступаем на несколько зыбкую почву: оксилипины и их роль в других группах организмов изучены не так хорошо, как у растений и позвоночных. Но все же попытаемся пройти вдоль основных эволюционных линий живого мира, опираясь на надежные вехи из научных публикаций. Знакомьтесь: мхи и печеночники (рис. 7) — растения, первыми колонизировавшие сушу.
Рисунок 7а. Фискомитрелла отклоненная (Physcomitrella patens) — модельный организм среди мхов. Практически все доступные на сегодняшний день сведения об оксилипинах у мхов получены на нем.
Рисунок 7б. Маршанция изменчивая (Marchantia polymorpha) — печеночник, тоже кое-что «рассказавший» нам об оксилипинах.
Первое отличие мхов от сосудистых растений — то, что они могут использовать как 20-углеродные, так и 18-углеродные полиненасыщенные жирные кислоты, то есть у них есть как эйкозаноиды, так и октадеканоиды. Но синтез обеих групп оксилипинов протекает у них почти как у высших растений, за исключением того — второе отличие! — что оксофитодиеновая кислота у мхов не укорачивается бета-окислением. Проще, говоря, у мхов нет жасмонатов — самых мощных растительных оксилипинов. «Веточка» метаболического пути, ведущая к жасмонатам, у мхов обрывается на оксофитодиеновой кислоте. Но есть функциональные параллели с функцией этого пути у растений: нарушение синтеза данной кислоты в результате мутаций лишает мох фертильности [9]. У растений утрата способности синтезировать жасмонаты или потеря их рецептора COI1 ведет к тому же эффекту [9]. Помимо этого, оксофитодиеновая кислота подавляет рост у мхов и их близких родственников — печеночников — как жасмонаты у растений [10].
Последний факт позволяет думать, что у мхов оксофитодиеновая кислота тоже может быть «гормоном стресса». Также известно, что мхи также начинают «плакать» оксилипинами в ответ на механическое повреждение или инфекцию [11]. Но связь оксилипинов мхов с конкретными защитными реакциями остается неясной. Да и у растений механизмы этой связи зачастую не прояснены до конца — если биохимия и молекулярная биология оксилипинов позвоночных изучена вдоль и поперек всеми возможными методами, то в случае с другими царствами мы зачастую располагаем лишь результатами экспериментального выключения гена какого-нибудь фермента. Таким образом, мы знаем, для чего организму нужен этот фермент и синтезируемые им оксилипины — но как осуществляется их функция, для нас остается загадкой. Пока мы знаем, что оксилипины нужны мхам для размножения, развития и защиты. Надеемся, что более подробные исследования впереди.
Не менее фрагментарно наше знание по поводу функции оксилипинов у красных и бурых водорослей. Установлено, что красные и бурые водоросли «плачут» оксилипинами в ответ на инфекцию, стресс или повреждение — но знание о путях биосинтеза этих оксилипинов и о физиологическом ответе на них пока находятся в процессе сбора по крупинкам. Если для растений и животных составлены подробные схемы биосинтеза оксилипинов, то про водоросли мы зачастую знаем только то, что у них есть липоксигеназа(-ы) с той или иной субстратной специфичностью [12]. Этого недостаточно, чтобы объяснить весь мир их оксилипинов, но это пока максимум из того, что мы знаем.
В частности, мы пока можем лишь догадываться, по какому конкретно пути у бурых и диатомовых водорослей происходит биосинтез феромонов, благодаря которым мужские и женские гаметы находят друг друга. Эти феромоны являются разветвленными или циклическими углеводородами, и на сегодняшний день есть убедительные доказательства [13], что формируются они из оксилипинов (примерно как летучие альдегиды и спирты у растений). И, скорее всего, по липоксигеназному пути — дальнейшие биохимические детали покрыты мраком. Но сам факт выполнения оксилипинами функции феромонов весьма примечателен.
Помимо этого, диатомовые водоросли, как высшие растения и животные, «плачут» оксилипинами в ответ на повреждение и используют их для иммунной защиты. Погодите, какое повреждение? И какой иммунитет? Ведь это одноклеточные водоросли!
Все в порядке! Конечно, диатомовые водоросли одноклеточны. Несмотря на то, что под микроскопом они выглядят как нить из клеток (рис. 8), клетки в нити никак не связаны между собой. И вполне закономерен вопрос, как можно «поранить» этот организм — скрести гвоздем его колонию на чашке Петри явно бессмысленно. И на первый взгляд непонятно, как выглядят инфекция и иммунитет у такого организма. Но ученые нашли способ это исследовать.
Рисунок 8а. Диатомовые водоросли Chaetoceros didymis
Рисунок 8б. Диатомовые водоросли Skeletonema costatum
Для моделирования повреждения у одноклеточных организмов используется метод нанесения акустической травмы ультразвуком. Выяснилось, что диатомеи при повреждении ультразвуком «плачут» смесью оксилипинов — и некоторые из них идентичны нашим. Так, израненный ультразвуком Chaerocetos didymis (рис. 8а) выделяет резольвины и HETE (которые синтезируются и в нашем организме при воспалении), а также 22-углеродные и 18-углеродные оксилипины [14].
Есть у диатомей и своя «чума». Возбудителя зовут Kordia algicida. Эта бактерия способна внедряться в сообщество диатомей в период цветения и разрушать их — такая вот инфекция у одноклеточного организма. Любопытно, что два вида диатомей, показанные на рис. 8, реагирует на инфекцию по-разному: C. didymis успешно с ней борется, в то время как S. costatum практически ничего не может ей противопоставить и погибает. Это означает, что у одноклеточной диатомеи C. didymis есть иммунитет, но как он работает? На этот счет пока известно немного. В ответ на присутствие вредоносной бактерии C. didymis выделяет протеазы, которые каким-то образом подавляют ее разрушительную активность. Каким — пока непонятно [15].
Но самое интересное, что, в отличие от S. costatum, C. didymis активизирует в присутствии Kordia algicida выработку оксилипинов. Видимо, это тоже помогает водоросли бороться с заразой. Пока описан только один возможный механизм наблюдаемой защиты — один из оксилипинов, выделяемых резистентной водорослью, действует как аналог растительных фитоалексинов и подавляет рост вредоносной бактерии [14], [15]. Пока неизвестно, выполняют ли ее оксилипины в процессе защиты какую-то координирующую и сигнальную роль, подобно животным и растительным аналогам. Многие детали здесь по-прежнему только ждут своего открытия. И снова наше знание сводится к фразе «для чего»: диатомовая водоросль использует оксилипины для иммунной защиты. Ну и в качестве феромонов.
Биосинтез оксилипинов у грибов настолько сложен (а местами не до конца ясен даже специалистам), что мы опишем его в общих чертах, крупными штрихами. Как читатель уже может догадаться, липоксигеназы у грибов есть. Правда, некоторые липоксигеназы грибов вместо «обычного» кофактора — железа — содержат марганец. Но биохимический механизм действия от этого сильно не меняется. Также, подобно растениям, у грибов есть алленоксидсинтазы — а вот алленоксидциклаз нет, то есть они не замыкают эпоксиды жирных кислот в цикл (или делают это пока неведомым нам способом) [16].
Бактерии и простейшие: вопрос на засыпку
Можно ли подвести под всю рассказанную выше «путаницу» какую-то общую черту — ведь не для развлечения читателя же мы все это пересказывали? Совершенно верно: у всех этих фактов есть одна центральная идея:
Представители всех описанных царств используют оксилипины для межклеточной сигнализации.
Вне зависимости от того, что хочет сказать клетка — «Помоги, меня тут едят!», «Не толкайся, ты!», «Иди ко мне, мы будем вместе!», — с помощью оксилипинов она посылает какой-то важный сигнал другой клетке. Чаще всего это происходит в пределах одного многоклеточного организма. Это самая общая функция оксилипинов во всем живом мире: служить общим химическим языком, неким биохимическом эсперанто.
Это может показаться примером впечатляющей эволюционной консервативности (то есть постоянства, сохранности). Но что-то утверждать по поводу эволюции мы пока не можем — мы слишком мало знаем об эволюции и функциях липоксигеназ за пределами растений, животных, грибов и водорослей (всех форм и расцветок). У самого эволюционного «корня» этих больших групп лежит пропасть незнания. Это несколько удручает — ведь, как говорил Феодосий Добжанский, «ничто в биологии не имеет смысла, кроме как в свете эволюции». Эту фразу мы не случайно вынесли в эпиграф статьи. Иметь столько удивительных фактов сходства функций и не иметь возможности связать их воедино с эволюционных позиций — значит, лишиться какого бы то ни было их осмысления.
Закономерным будет вопрос: а что мы знаем про оксилипины за пределами домена эукариот и у самых примитивных его представителей — тех, что мы называем «простейшие»? Ответ: знаем очень мало.
Авторы прекрасно отдают себе отчет, что термин «простейшие» является устаревшим, и в современной систематике, основанной на филогенетике, ему просто нет места. Но используем мы его здесь от безысходности, потому что
А почему — скажем чуть позже.
Как в случае с водорослями, мы знаем, что у некоторых бактерий есть липоксигеназы. Их биохимия описана для нескольких видов цианобактерий и миксобактерий. Как и у многоклеточных эукариот, эти липоксигеназы превращают жирные кислоты в гидропероксиды, которые затем конвертируются в гидроксиды (аналоги наших HETE). Нарисовать подробную схему биосинтеза оксилипинов для бактерий пока невозможно — как для водорослей.
Липоксигеназы удобны своей впечатляющей консервативностью — как читатель мог убедиться выше, почти у всех живых организмов это семейство ферментов выполняет одни и те же функции. Что не скажешь о циклооксигеназах, альфа-диоксигеназах растений и диолсинтазах грибов — их ближайшие гомологи «работают» у других организмов пероксидазами и каталазами. Более того, в основе липоксигеназы — консервативный домен, узнаваемый специальными программами даже просто при анализе аминокислотной последовательности. За счет этого липоксигеназу не с чем спутать при биоинформатическом анализе, и можно оценить ее распространенность, просто «просканировав» генные и белковые базы данных средствами биоинформатики.
Для бактерий такие оценки были сделаны — вероятные липоксигеназы обнаружены в 0,5% бактериальных геномов, секвенированных на сегодняшний день. У архей липоксигеназ таким методом не найдено [18–20].
0,5% — это много или мало? Скорее, это не очень понятно. Это означает, что большинство бактерий спокойно обходится без липоксигеназ, но все же сотни из них этот фермент имеют. Подчеркнем: это почти тот же самый фермент, который производит лейкотриены в организме читателя и жасмонаты в организме герани на его окне. Но сведения о функции этого фермента у бактерий крайне скудны. И тем более непонятно, почему 0,5% бактерий с ним так повезло, а всем остальным — нет.
В далеком 2007 году немецкие исследователи попытались сделать с цианобактерией Nostoc punctiforme то же самое, что другая группа проделала с диатомовыми водорослями — изранили ностока ультразвуком. Выяснилось, что бактерия, как и диатомовая водоросль, при этом «плачет» оксилипинами — продуктами липоксигеназ [21]. Только в этом исследовании не была изучена реакция других клеток бактерии на этот «плач» и его возможная биологическая роль. Что здесь делает «адресат» возможного сообщения, так и остается неясным. У бактерии Myxococcus xanthus, наоборот, только ответ и был исследован — добавление к культуре бактерии ее собственного оксилипина усиливало ее дергающуюся подвижность [22]. Непонятно, на что она таким образом отвечает в реальных условиях.
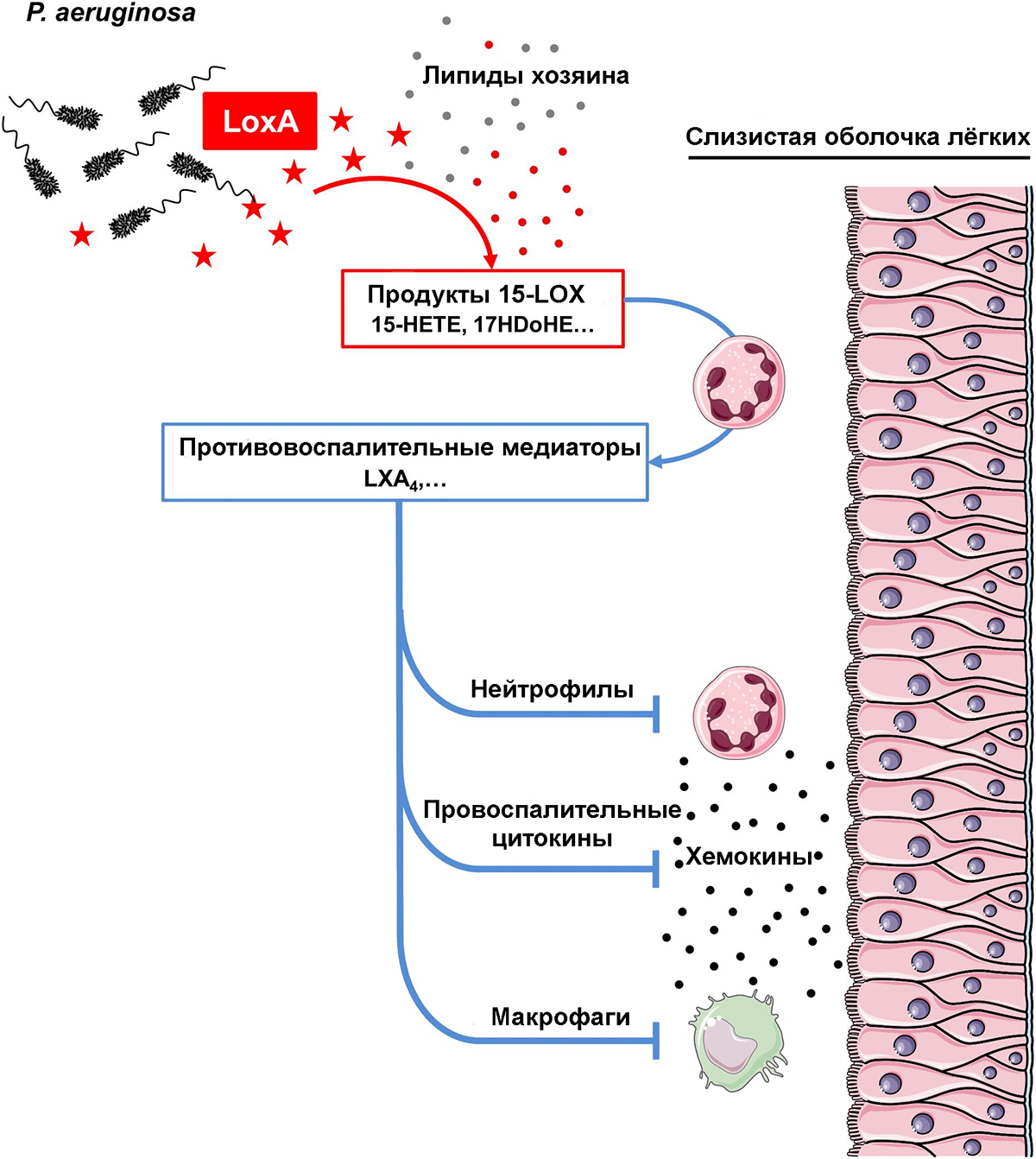
На этом фоне прорывом выглядят опубликованные сведения о функции липоксигеназы и оксилипинов у опасного внутригоспитального патогена — синегнойной палочки (Pseudomonas aeruginosa). Она ими пользуется для искусного обхода иммунного ответа хозяина (рис. 9) [23].
Рисунок 9. Механизм действия липоксигеназы P. aeruginosa. Оксилипины, синтезируемые ею из жирных кислот хозяина, в дальнейшем в нейтрофилах «превращаются» в липоксины. Последние подавляют реакцию макрофагов, синтез защитных хемокинов и активность самих нейтрофилов. Вывод из строя трех этих важных звеньев защиты облегчает бактерии инвазию.
В самом начале статьи мы упоминали, что у человека есть несколько групп эйкозаноидов, тормозящих воспаление, и среди них липоксины. Они служат для своевременного завершения реакции на повреждение. Конечно, их синтез вряд ли будет преобладать в тот момент, когда в ткани вовсю рвется какой-то прокариот. если у прокариота нет с собой «карманной» липоксигеназы, направляющей синтез эйкозаноидов по нужному пути! А она у синегнойной палочки есть!
Предшественники липоксинов бактерия делает прямо из липидов хозяина — своих ПНЖК у нее нет. Эти предшественники затем подхватываются макрофагами — и на выходе получаются липоксины. Все иммунные клетки воспринимают их однозначно: это сигнал «Отбой тревоги!» Иммунная защита в месте инвазии отключена, и бактерия может спокойно делать свое черное дело. Бактерия хитро подделывает сигнал, используемый нашей иммунной системой.
И все же синегнойная палочка — это всего одна бактерия из нескольких сотен «счастливых» обладателей липоксигеназы. И мы вновь возвращаемся к тому, что нам нечего сказать за весь бактериальный мир — зачем же его представителям липоксигеназы?
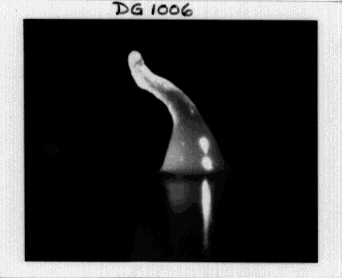
Что касается простейших, то с ними все еще грустнее. Липоксигеназа вскользь описана только у одного представителя — социальной амебы Dictyostelium discoideum — и то только в базе данных, а не в отдельной публикации. Dictyostelium discoideum в сытом состоянии — обычная почвенная амеба. Но при голодании эти амебы сбиваются вместе и формируют многоклеточный агрегат, перемещающийся как единое целое — или вообще плодовое тело, напоминающее гриб. Отмечено, что у мутантного по гену липоксигеназы диктиостелия нарушено формирование плодового тела — оно не происходит до конца (рис. 10).
Рисунок 10а. Dictyostelium discoideum в норме формирует красивые плодовые тела на ножке
Рисунок 10б. Мутантный по гену липоксигеназы Dictyostelium discoideum не может завершить развитие и останавливается на стадии «пальца»
Но, повторимся, эти данные не были обсуждены даже в отдельной статье — поэтому для понимания функций оксилипинов у простейших это крайне отрывочные сведения.
Биоинформатики спешат на помощь
Идея нашего исследования, опубликованного в журнале «Биохимия» [19] и его англоязычной версии Biochemistry (Moscow) [20], довольно проста. Мы решили «просканировать» белковые последовательности бактерий и простейших в базах данных и найти среди них липоксигеназы. А затем поискать ассоциации между наличием этого фермента и какими-нибудь особенностями его обладателя.
Конечно, биоинформатические методы могут показаться менее «доказательными», чем экспериментальные. Однако есть одно «но»: гораздо больший объем данных. Биоинформатика проигрывает эксперименту на уровне одного вида, но не особенно уступает ему там, где речь идет о многих видах сразу. Если обнаружена закономерность сразу на многих видах — уже не так страшно, если с двумя-тремя вышла ошибка (например, у них липоксигеназа оказалась неактивна, так как кодируется псевдогеном).
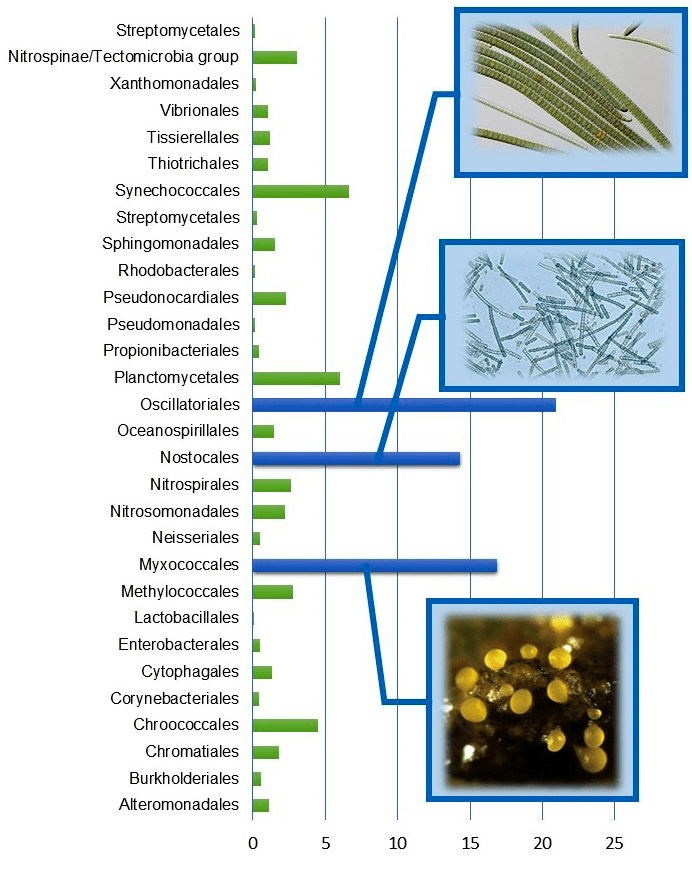
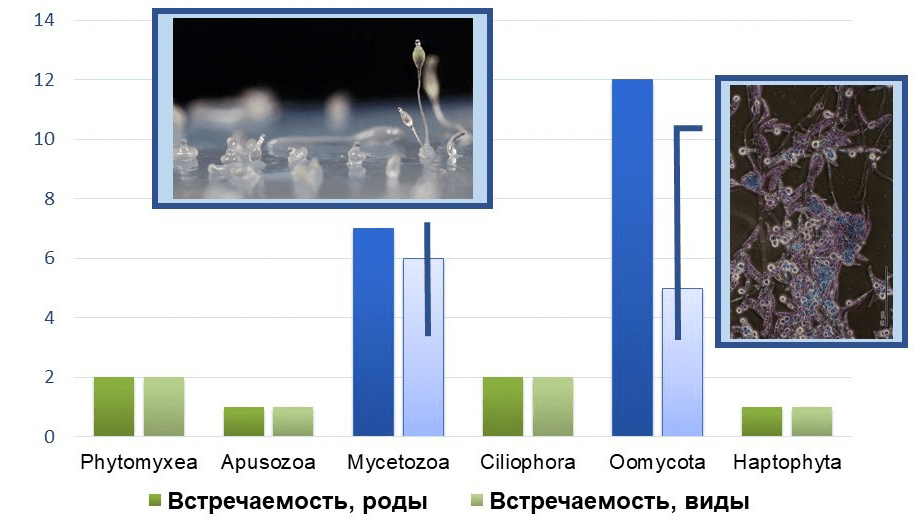
Начали мы с простой статистики: подсчитали встречаемость липоксигеназ в каждом порядке бактерий и крупном таксоне простейших. Уже на этом этапе как среди бактерий, так и среди простейших обнаружились таксоны-лидеры по части обладания липоксигеназами (рис. 11).
Рисунок 11а. Встречаемость липоксигеназ в разных таксонах бактерий. Фотографии иллюстрируют общую особенность таксонов с высокой встречаемостью: многоклеточность.
коллаж автора статьи
Рисунок 11б. Встречаемость липоксигеназ в разных таксонах простейших. Фотографии иллюстрируют общую особенность таксонов с высокой встречаемостью: многоклеточность.
коллаж автора статьи
У бактерий особенно много обладателей липоксигеназ среди миксобактерий (Myxococcales), а также цианобактерий порядков ностоковые (Nostocales) и осциллаториевые (Oscillatoriales). Среди простейших выделяются миксомицеты (Mycetozoa) и оомицеты (Oomycota). Все эти таксоны объединяет одна важная черта: многоклеточность. Нет, мы не ошиблись. И читатель понял всё верно: многоклеточные бактерии и многоклеточные простейшие существуют. Начнем с цианобактерий.
Рисунок 12а. Многоклеточные цианобактерии Cylindrospermum sp. — представитель ностоковых. Хорошо видны многоклеточные нити бактерии и клетки, выделяющиеся более насыщенным цветом и большим размером. Это гетероцисты — один из клеточных типов бактерии. Эти клетки занимаются фиксацией азота. А обычные клетки — вегетативные, их задача — фотосинтез.
Рисунок 12б. Многоклеточные цианобактерии Oscillatoria sp. — представитель осциллаториевых. В отличие от ностоковых, они не дифференцируются на два клеточных типа — все клетки одинаковы.
Под микроскопом цианобактерии на первый взгляд похожи на уже рассмотренных диатомей — они выглядят как ниточка (рис. 12). Но по физиологии скорее напоминают нитчатые зеленые водоросли (такие как улотрикс), потому что все клетки в нити соединены в подобие единого организма. Между ними есть контакты-микроплазмодесмы (аналог плазмодесм растений), через которые они обмениваются метаболитами. А ностоковые вообще способны дифференцироваться на два клеточных типа: вегетативные клетки и гетероцисты (рис. 12а). Как выразился палеонтолог и специалист по теории эволюции Александр Марков в одной из своих научно-популярных статей [27]:
Нитчатые цианобактерии со специализацией клеток — одна из наиболее далеко зашедших “попыток” эволюции создать многоклеточный организм на прокариотной основе.
Миксобактерии и миксомицеты, несмотря на принадлежность к разным доменам (первые — бактерии, вторые — эукариоты), в некотором роде коллеги. Их конвергентная эволюция привела к сходным формам многоклеточности. Они занимают похожую экологическую нишу: живут в лесной подстилке, в почве, на разлагающейся листве и древесине, а питаются другими бактериями. Миксобактерии при голодании сбиваются в «рой» или «волчью стаю», коллективно охотясь на своих жертв. А если станет уже совсем голодно, соединяются в единый многоклеточный организм, развиваясь в красивые плодовые тела (рис. 13а). Примерно то же самое способны делать миксомицеты — они способны сбиться не только в стаю, но и в подвижный агрегат, который ползает и охотится, как настоящий многоклеточный организм. Плодовые тела у них не менее впечатляющие (рис. 13б). К ним относится уже упомянутый Dictyostelium discoideum.
Рисунок 13а. Представители двух доменов со сходной жизненной стратегией. Миксобактерия Myxocccus xanthus (плодовые тела).
Рисунок 13б. Представители двух доменов со сходной жизненной стратегией. Слизевик Dictyostelium discoideum (также плодовые тела).
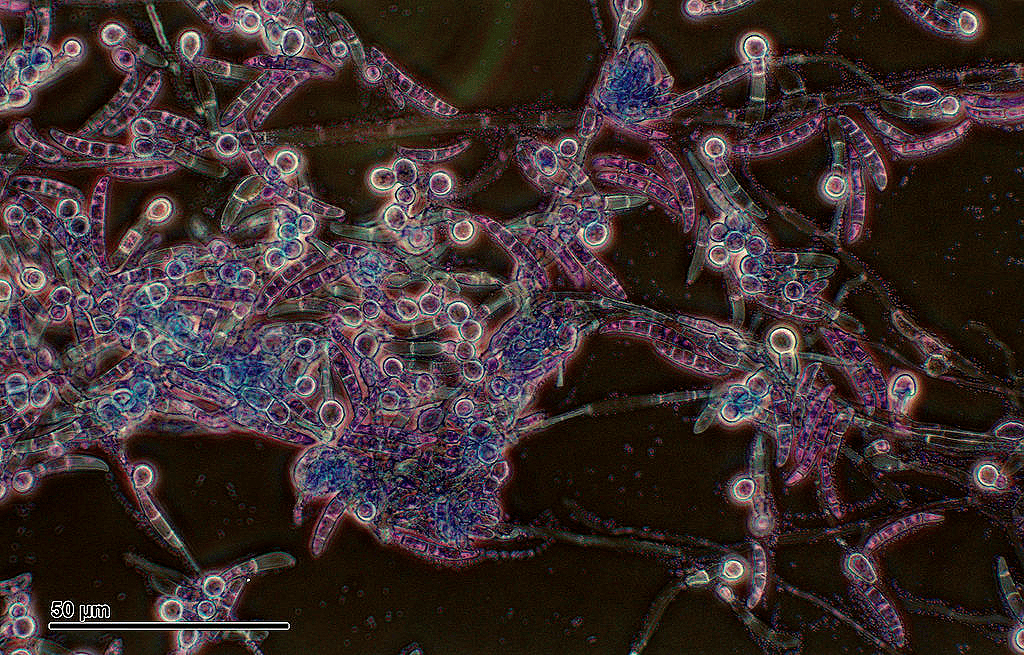
Рисунок 14. Мицелий оомицета Pythium sp., похожий на мицелий грибов
Теперь понятно, что мешало нам использовать термин «одноклеточные эукариоты» вместо «простейшие» — ведь дальше по ходу повествования на сцену выходят их многоклеточные представители! У нас не оставалось другого выбора, как возродить уже несколько архаичный термин.
В общем, лидерами по встречаемости липоксигеназ оказались таксоны, на которых эволюция «экспериментировала» в создании примитивной многоклеточности. Напрашивается вывод: липоксигеназы у бактерий и простейших связаны с многоклеточностью. Похоже на то, но сначала мы решили провести филогенетический анализ.
Разница между деревьями и сетями немного обсуждается в статье «Внимание! Разыскивается предок митохондрий!» [28], там же есть полезные ссылки на этот счет.
За кадром
Именно написание этой статьи (для конкурса «Био/Мол/Текст-2019») вдохновило нас воспользоваться филогенетическими сетями и в своей работе. Спасибо «Биомолекуле» за стимулы к новым исследованиям!
Зачем такие сложности? У нас были основания предполагать, что липоксигеназы между бактериями распространяются вертикально — не от общего предка к потомкам, а горизонтальным переносом генов между разными видами. Такая картинка больше напоминает как раз сеть, а не дерево — так что лучше для надежности запастись двумя видами моделей.
Предчувствия не обманули: в основном бактерии передавали друг другу липоксигеназы именно горизонтальным переносом. Иначе не объяснить, каким образом эволюционно отдаленные группы бактерий кластеризуются вместе (рис. 15). Например, почему один из кластеров цианобактерий расположился по соседству с микобактериями, они вообще в разных типах. Стоп, а откуда вообще два кластера?
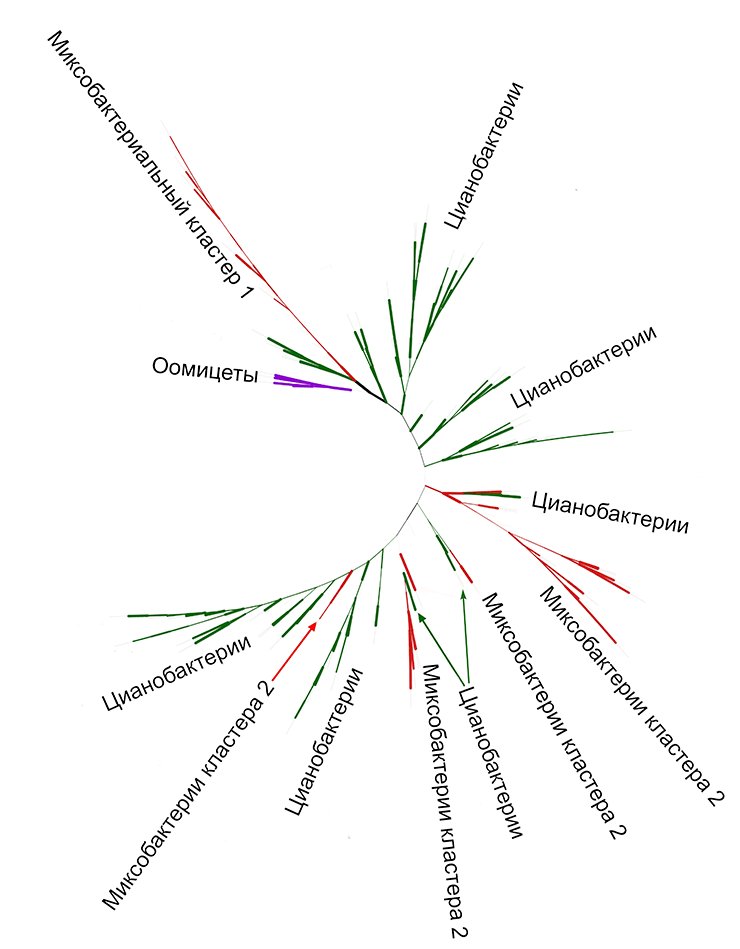
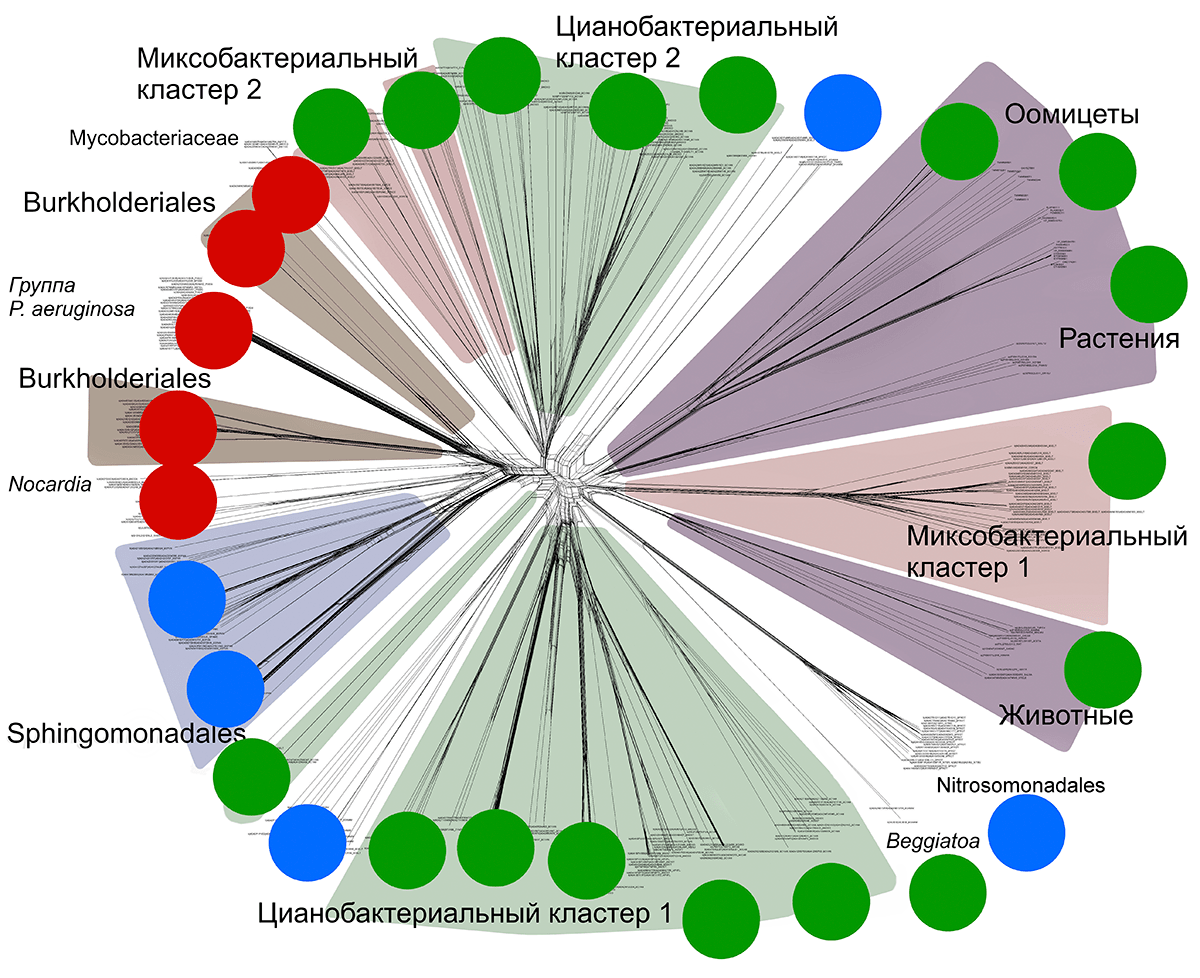
Рисунок 15. Филогенетическая сеть для всей выборки липоксигеназ (включая некоторых эукариот). Зеленым цветом обозначены цианобактерии, красным — миксобактерии. Заметно, что обе группы разбиваются на два больших «куста» (кластера). Фиолетовым обозначены все эукариоты, синим — представители порядка прокариот Sphingomonadales, коричневым — представители порядка Burkolderiales. Рисунок в максимальном разрешении.
Действительно, на рисунке 15 четко видны два зеленых кластера цианобактерий и два красных — для миксобактерий. Причем кластеры в каждой паре не просто далеко отстоят друг от друга, а вообще расположены в разных углах сети. При детальном анализе к тому же выяснилось, что 15–20% штаммов присутствуют в обоих кластерах одновременно (это верно как для цианобактерий, так и для миксобактерий). Что за бактерии Шредингера такие?
Здесь и нам, и читателю вслед за нами придется несколько изменить эволюционное мышление. Мы говорим сейчас об эволюции конкретного белка, которая не всегда соответствует эволюции самих видов. Поэтому сами бактерии эволюционировали как обычно — а вот два кластера липоксигеназ, очевидно, происходят от двух разных изоферментов, давших потомков среди цианобактерий и миксобактерий. Некоторые штаммы сохранили оба изофермента, поэтому и присутствуют в обоих кластерах.
Но кто первый «изобрел» эти два изофермента липоксигеназы? Кто был вначале — цианобактерии или миксобактерии?
Для ответа на этот вопрос мы построили дополнительные сети и деревья для циано- и миксобактерий. Дело в том, что на «общих» сетях и деревьях часть последовательностей неизбежно теряется из-за технических моментов — мы вынуждены ими жертвовать, чтобы иметь возможность построить модель. При «прицельном» расчете теряется гораздо меньше информации — это позволяет четче увидеть эволюционную картину.
Из рисунка 16 интуитивно понятно, что сначала были все-таки цианобактерии — красные ветви цианобактерий отходят из зеленых «кустов» цианобактерий, а не наоборот. Также хорошо видно, что миксобактерии заимствовали липоксигеназы у цианобактерий несколько раз. Более подробные выкладки приведены в нашей статье в «Биохимии» [19], [20].
Рисунок 16. «Прицельное» филогенетическое дерево для липоксигеназ цианобактерий (зеленые) и миксобактерий (красные). Толщина ветвей наглядно отображает величину их статистической значимости — бутстреп-поддержки. Оомицеты использованы с технической целью как внешняя группа, то есть на них можно не обращать внимания. Заметно, что красные ветви находятся среди зеленых — это значит, что миксобактерии заимствовали свои липоксигеназы у цианобактерий (а не наоборот).
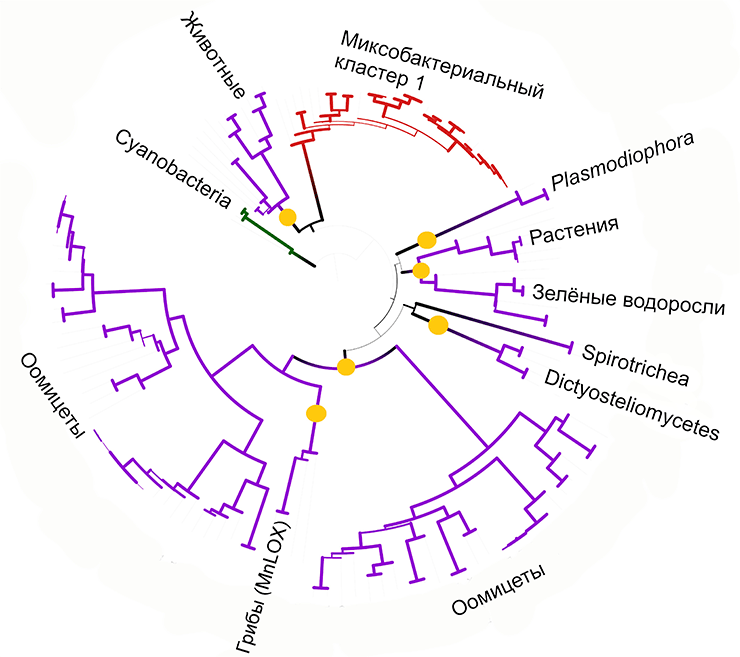
Теперь нужно было реконструктировать эволюцию липоксигеназ у эукариот. Для этого мы учли статистическую значимость каждой ветки (так называемую величину бутстреп-поддержки), расположение липоксигеназ эукариот на «общем» и «прицельном» дереве и эволюцию соответствующих таксонов (напоминаю, что деревья показывают эволюцию одного белка). Собрав эти данные воедино, мы выделили на дереве предположительные события обретения липоксигеназ группами многоклеточных эукариот (рис. 17).
Рисунок 17. «Прицельное» филогенетическое дерево для липоксигеназ эукариот. Желтые кружки изображают предполагаемые события независимого обретения липоксигеназы многоклеточными эукариотами (нанесены специально для научно-популярных целей).
[19], рисунок с изменениями
Основная наша находка состоит в том, что таких событий было несколько. Они были независимы друг от друга, и, что самое главное, эволюционно связаны с событиями обретения многоклеточности.
Скорее всего, липоксигеназы впервые были изобретены цианобактериями. У них их позаимствовали другие многоклеточные бактерии — миксобактерии. Отдельные клады эукариот также заимствовали липоксигеназы — пока не знаем, от кого именно, но как раз в те периоды своей истории, когда у них возникала многоклеточность. Даже если она возникала в примитивной форме (как у миксомицетов), ей сопутствовали липоксигеназы. Получается, что липоксигеназы бактерий и простейших связаны с многоклеточностью — не только статистически, но и эволюционно. Такая закономерность сохраняется во всем живом мире. Она объясняет, почему липоксигеназы есть только у 0,5% бактерий, но почти у всех растений и многих таксонов животных. Наше исследование просто позволяет увидеть эту закономерность четче. И теперь мы знаем, что липоксигеназы эволюционно сопутствовали обретению многоклеточности.
А сыграли ли они в нем какую-то роль? Мы пока не знаем. «После этого» (или одновременно с этим) вовсе не значит «вследствие этого». Найденная связь подтверждает гипотезу, что и микроорганизмы используют липоксигеназу для синтеза сигнальных оксилипинов, как растения и животные. И что авторами такой идеи были все-таки бактерии. Но насколько такая коммуникация критична для возникновения многоклеточности? На этот вопрос еще надлежит ответить. Он весьма интригующий — вдруг ключ к сложности современного живого мира лежит именно здесь?
Гении и злодеи
А как же синегнойная палочка, использующая липоксигеназу для вторжения в организм человека? Она одна придумала такой трюк? Вовсе нет. Наш дополнительный статистический и эволюционный анализ выявил, что таких бактерий может быть много. И это значительно увеличивает масштаб проблемы.
Среди тех бактерий, которые вошли в нашу выборку (по причине наличия липоксигеназы), многие не обладали многоклеточностью ни в каком виде. Их мы отдельно распределили на группы по экологическим особенностям (табл. 1).
В первую группу — патогенных для человека бактерий — и попала синегнойная палочка. Все остальные представители этой группы оказались ее «коллегами»: они также неопасны или малоопасны для здоровых людей, но очень опасны для людей с ослабленной иммунной системой или сопутствующими заболеваниями. Таких бактерий называют оппортунистическими. Также почти все представители этой группы особенно опасны для пациентов больниц и распространяются внутри них. Такие патогены называют нозокомиальными. Наконец, у них довольно сходные перечни клинических форм поражения — сепсис, хирургическая инфекция кожи и подкожной клетчатки и поражение легких. Кстати, о легких — многие из этих бактерий опасны для пациентов с муковисцидозом, как и сама синегнойная палочка.
Еще одна характерная черта бактерий из этой группы — это легкая смена хозяев, причем даже если они относятся к разным царствам. По-английски это называется cross-kingdom host jump, а в русском языке, к сожалению, устоявшегося термина нет — в статье в «Биохимии» [19] мы перевели как «межцарственный перескок».
Примером может служить та же синегнойная палочка, которая (как и ряд буркхолдерий) способна поражать не только человека, но и растения.
За кадром
Это была не первая трудность перевода, с которой нам пришлось столкнуться. Например, в русском языке нет точного аналога такому актуальному на сей день термину, как emerging pathogen — а такие патогены в нашей выборке тоже были. Да и в принципе слово cross-kingdom с очень широким значением, обозначающее взаимодействие между царствами или распространение за их пределы, на русский язык переводится с трудом — мы воспользовались тем же переводом «межцарственный», хотя его ассоциативный ряд в русском языке несколько другой. Это вовсе не значит, что русский язык хуже английского — просто для многих терминов еще только предстоит выработать емкие русские аналоги.
Рисунок 18. Та же самая филогенетическая сеть, что и на рисунке 15 — только здесь мы цветными кружками обозначили предполагаемую роль липоксигеназы в каждом кластере. Зеленый круг обозначает многоклеточность, красный — вирулентность, синий — «мы не знаем». Рисунок в максимальном разрешении.
[19], рисунок с изменениями
Рисунок 19. Филогенетическое дерево, показывающее «сверхраспространение» липоксигеназы синегнойной палочкой. Здесь, в отличие от предыдущих деревьев, статистическая значимость ветвей показана цветом (красный — «мы вообще не уверены в этой ветви», ярко-зеленый — «уверены в ней абсолютно»). Как видно из этого дерева, с уверенностью можно говорить о том, что синегнойная палочка поделилась своими липоксигеназами с Acinetobacter baumannii, Streptococcus equisimilis, Klebsiella pneumoniae, Enterobacter cloacae.
[19], рисунок с изменениями
Как и в случае с многоклеточностью, мы сделали вывод, что липоксигеназы у определенной группы бактерий ассоциированы с вирулентностью. И, скорее всего, эти бактерии используют ту же самую стратегию, что описана для синегнойной палочки: синтезируют оксилипины, с помощью которых «обманывают» иммунную систему хозяина. В переводе на языковые аналогии получится, что бактерии говорят хозяину голосом его клеток: «Все хорошо, ложная тревога!» — и продолжают свое черное дело, ослабив иммунную систему. То есть такая функция оксилипинов тоже является разновидностью коммуникации — еще одной гранью «биохимического эсперанто».
Как можно видеть по рис. 18, эта функция эволюционно вторична: вначале бактерии изобрели липоксигеназу для поддержания оксилипиновой коммуникации между клетками. По этому же рисунку видно, что оксилипиновый «язык эсперанто» прижился как у многих бактерий, так и у эукариот. Но небольшая группа бактерий научилась использовать его для обмана, щедро поделившись с другими «злодеями».
Дополнительно почитать об антибиотикорезистентности и способах ее преодоления можно в теме «Антибиотики».
Мы пока размышляем, что делать с этими данными, — для нас они оказались неожиданностью. Первоначально наша работа задумывалась как чисто эволюционная — но так уж получилось, что с медицины мы эту статью начали, медициной и заканчиваем. Пока мы продолжаем эволюционную часть нашего исследования и не знаем, удастся ли продолжить медицинскую. Но и это вполне возможно — ведь медицинское знание тоже иногда приобретает новые смыслы в свете эволюции.
За кадром
Оригинальная статья в «Биохимии» [19] написана коллективом из трех авторов: Георгия Куракина, Анны Самоукиной и Надежды Потаповой (редактора «Биомолекулы»). Познакомились соавторы не в последнюю очередь благодаря предыдущему конкурсу «Биомолекулы» — «БиоМолТекст-2019». Мы выражаем благодарность «Биомолекуле» за то, что она служит не только научно-популярным изданием, но и отличной площадкой для создания новых коллабораций!