церебральный васкулит что это такое
Церебральный васкулит
Церебральный васкулит — это заболевание, вызванное воспалительным процессом в стенке мозговых сосудов. Возникает в основном вторично. Проявления вариабельны: энцефалопатия, парезы, психические нарушения, эпилептические приступы, обмороки, зрительные расстройства, тугоухость, атаксия. Диагностика опирается на клинические сведения, данные неврологического статуса, результаты МРТ, церебральной ангиографии, исследования ликвора, биохимии крови. Лечение проводится дифференцированно в соответствии с этиологией и клиническими особенностями. Может включать кортикостероиды, цитостатики, сосудистые препараты, ноотропы, симптоматические средства.
МКБ-10
Общие сведения
Церебральный васкулит (ЦВ) возникает преимущественно в структуре системных васкулитов или на фоне инфекций, ревматических заболеваний, онкопатологии, интоксикаций. Термин «васкулит» означает воспалительное поражение сосудистой стенки. Изолированный васкулит мозговых сосудов относится к редким формам. Точная заболеваемость не установлена, поскольку отсутствуют специфические клинико-инструментальные диагностические критерии ЦВ. Ряд авторов указывают распространённость патологии — 2-3 случая на 100 тыс. человек. Заболеванию подвержены лица от 7 до 71 года, наиболее часто – представители возрастной категории от 30 до 60 лет. Гендерные различия в заболеваемости не прослеживаются.
Причины
Этиология идиопатического (первичного) изолированного поражения церебральных сосудов неизвестна. Не исключена роль травматических повреждений, стрессов, переохлаждений как триггеров, провоцирующих дебют васкулита. В литературе по неврологии описаны случаи развития заболевания после черепно-мозговой травмы. Причинами вторичного ЦВ могут выступать:
Патогенез
Механизм развития изолированного ЦВ не установлен. Морфологически в сосудистой стенке выявляются инфильтраты (скопления одноядерных клеток), наблюдается формирование гранулём. Вторичный церебральный васкулит при системных сосудистых и ревматических заболеваниях имеет аутоиммунный патогенез: сосудистая стенка повреждается антителами, вырабатывающимися к её элементам вследствие неадекватной реакции иммунной системы. В остальных случаях воспалительный механизм запускается прямым воздействием этиофактора (токсинов, бактерий, вирусов).
Воспаление сосудистой стенки приводит к её истончению, сужению сосудистого просвета, повышенной проницаемости. Развиваются гемодинамические расстройства, ухудшается кровоснабжение отдельных участков головного мозга, возникают эпизоды церебральной ишемии, лакунарные инфаркты, мелкоочаговые кровоизлияния. Обычно церебральный процесс носит распространённый множественный характер.
Классификация
Наблюдаются существенные различия в течении идиопатических и вторичных форм ЦВ. Поэтому клиническую значимость имеет разделение заболевания в соответствии с этиологией на:
Подобно системным васкулитам, церебральный процесс протекает с преимущественным вовлечением артерий определённого калибра. В зависимости от диаметра выделяют:
Симптомы церебрального васкулита
Первичный церебральный васкулит
Имеет острую манифестацию с интенсивной головной боли, эпилептического пароксизма или внезапного появления очагового неврологического дефицита. Отдельные исследователи указывают на возможность продолжительного субклинического периода, предшествующего дебюту заболевания. В последующем реализуется один из следующих вариантов симптоматики: острая энцефалопатия с психическими расстройствами, многоочаговые проявления, сходные с клиникой рассеянного склероза, общемозговые и очаговые симптомы, типичные для объёмного образования мозга.
Наиболее характерна пирамидная недостаточность в виде пареза одной, чаще двух, конечностей с повышением тонуса мышц и рефлексов. Ряд случаев сопровождается стоволово-мозжечковым симптомокомплексом: нистагм (подёргивание глазных яблок), мозжечковая атаксия (шаткость походки, дискоординация, несоразмерность движений), расстройство глазодвигательной функции. Возможны нарушения речи (афазия), выпадение части зрительных полей (гемианопсия), судорожный синдром (симптоматическая эпилепсия).
Вторичный церебральный васкулит
Отличается постепенным нарастанием проявлений. В начальном периоде больные жалуются на ухудшение слуха, ослабление зрения, головную боль, предобморочные эпизоды, опущение верхнего века. Развёрнутый период зависит от основной патологии. Вовлечение мозговых сосудов в рамках системного васкулита проявляется гиперкинезами (непроизвольными двигательными актами), обмороками, эпизодами катаплексии и нарколепсии, судорожными приступами.
Церебральный васкулит ревматической этиологии характеризуется клиникой преходящей малой хореи с приступообразным возникновением гиперкинеза. Васкулит мозга при СКВ в 60% случаев протекает с транзиторными психическими отклонениями (беспокойством, расстройством поведения, психозами). Частыми проявлениями ЦВ туберкулёзного генеза выступают парезы, хореоатетоз, дизартрия, нарушения ориентации. При реккетсиозах наблюдаются коматозные состояния, судорожные пароксизмы.
Осложнения
Острое расстройство мозгового кровоснабжения в зоне поражённой васкулитом мозговой артерии приводит к возникновению инсульта. Чаще наблюдаются мелкоочаговые ишемические инсульты, носящие повторный характер. Истончение патологически изменённой сосудистой стенки может осложниться разрывом и геморрагическим инсультом. Возникающая вследствие васкулита хроническая ишемия мозга приводит к снижению когнитивных функций (памяти, внимания, мышления), формированию деменции. Осложнением судорожного синдрома является эпилептический статус. В редких случаях течение заболевания может привести к развитию комы.
Диагностика
Неоднородность механизмов возникновения, течения, клинической картины ЦВ существенно осложняют постановку диагноза, требуют участия нескольких специалистов: невролога, ревматолога, инфекциониста, психиатра. Важное значение имеет выявление/исключение базового заболевания. Основными этапами диагностического алгоритма являются:
Дифференцировать церебральный васкулит следует с многоочаговыми энцефалитами, церебральным атеросклерозом, демиелинизирующей патологией (рассеянным склерозом, оптикомиелитом, склерозом Бало). У молодых больных необходимо исключить антифосфолипидный синдром.
Лечение церебрального васкулита
Терапия изолированных форм, вторичного церебрального поражения при системных и ревматических васкулитах проводится глюкокортикостероидами. Состоит из 2 этапов: ударного и поддерживающего лечения. В тяжёлых случаях стероиды комбинируют с цитостатиками (азатиоприном, циклофосфамидом). Базовая терапия других вариантов вторичного васкулита зависит от основной патологии. Инфекционная этиология требует соответствующего антибактериального или противовирусного лечения, токсическая — дезинтоксикации.
С целью улучшения мозгового кровотока применяются вазоактивные препараты, средства улучшающие реологические свойства крови. Поддержание метаболизма нервных клеток, стимуляция когнитивных функций осуществляется назначением ноотропов. В комплексное лечение входит симптоматическая терапия, лечебная физкультура и массаж паретичных конечностей, занятия с логопедом (при расстройствах речи) и т. д.
Прогноз и профилактика
В целом церебральный васкулит поддаётся лечению и имеет благоприятный прогноз. Некоторые неврологи указывают на лучший эффект терапии у больных с хорошо накапливающими контраст МР-очагами Трудности диагностики в ряде случаев приводят к запоздалой постановке диагноза и позднему началу терапии, что обуславливает прогрессирование симптоматики до глубокой инвалидизации, летального исхода. Специфическая профилактика отсутствует. Предупреждение вторичного ЦВ сводится к исключению интоксикаций, своевременному лечению инфекций и системных болезней.
Васкулит – что это за болезнь? Симптомы, причины и лечение, запись на прием к специалисту клиники МЕДСИ
Оглавление
Васкулит – патология, поражающая крупные, средние и мелкие сосуды и характеризующаяся воспалением стенок артерий, вен, венол, артериал и мелких капилляров. Заболевание является не только неприятным для пациента, но и опасным. Точный диагноз может поставить лишь опытный ревматолог. Он же справится и с задачей непростого лечения васкулита.
Причины патологии
Точные причины заболевания неизвестны. Нередко патология возникает даже у абсолютно здорового человека.
Обычно васкулиты возникают на фоне:
К предрасполагающим факторам относят:
Васкулит может возникнуть и как осложнение реактивного артрита или красной волчанки.
Классификация
В зависимости от причин возникновения васкулиты делятся на:
В зависимости от локализации выделяют:
В некоторых случаях одновременно поражаются как мелкие и средние, так и крупные сосуды.
Симптомы васкулита
Основными признаками и симптомами васкулита, являющимися поводом для обращения к врачу и начала лечения, являются:
Симптомы васкулита у детей, после обнаружения которых следует обратиться к специалисту для лечения, являются таким же. Причем малыши страдают патологией чаще, чем взрослые. Наиболее подвержены недугу дети в возрасте от 4 до 12 лет. Как правило, развивается болезнь Кавасаки и другие системные васкулиты. У несовершеннолетних больных патология поражает мелкие сосуды эпидермиса, суставы, органы желудочно-кишечного тракта и почки.
Важно! Если своевременно не обратиться к врачу, не пройти диагностику и не начать лечение васкулита, заболевание перейдет в хроническую форму. Периодически пациент будет страдать от рецидивов патологического состояния.
Диагностика
Перед началом лечения всегда проводится диагностика васкулита. Она позволяет определить особенности течения заболевания и выявить его причину.
Лечение васкулита
Лечение васкулита направлено на:
В комплексной терапии применяются средства для:
Такое лечение включает:
Такое лечение васкулита проводится при наличии признаков тромбоза глубоких вен. Назначается оно только по строгим показаниям. Методики отбираются специалистами.
Профилактика
Васкулит на ногах и других частях тела часто не имеет не только ярко выраженных симптомов, но и причин, поэтому затрудняется не только его лечение, но и профилактика.
Тем не менее рационально:
В целях профилактики вторичной формы патологии следует:
Диета при васкулите
Основой питания при патологии является исключение аллергенов (цитрусовых, яиц, усилителей вкуса, меда, грибов, промышленных консервантов и др.).
Точную диету составит ваш лечащий врач. Он же даст и рекомендации, касающиеся образа жизни в целом. Это позволит как сократить симптомы заболевания, так и (в некоторых случаях) снизить дозировки принимаемых лекарственных препаратов.
Преимущества лечения васкулита в МЕДСИ
Если вы хотите записаться на прием к врачу и пройти лечение васкулита, позвоните нам
Церебральный васкулит что это такое
Первичный васкулит (ПВ) центральной нервной системы (ЦНС) — редкое заболевание, вовлекающее исключительно сосуды головного, реже спинного мозга и их оболочек, причина которого до настоящего времени остается нераскрытой, а клиническая диагностика сопряжена с немалыми трудностями. В литературе ПВЦНС также описывается под названиями: первичный ангиит ЦНС, изолированный васкулит (ангиит) ЦНС [1—4]. Термин ПВЦНС закреплен в номенклатуре васкулитов, принятой на международной конференции, состоявшейся в 2012 г. и посвященной ее пересмотру (International Chapel Hill Consensus Conference Nomenclature of Vasculitides), и отнесен к рубрике васкулитов одного органа [5]. Термин «первичный» подразумевает, что васкулит не является вторичным по отношению к каким-либо другим заболеваниям. Ко вторичным васкулитам, с которыми необходимо дифференцировать ПВЦНС, относятся болезнь Такаясу, гигантоклеточный артериит (поражение артерий крупного калибра), узелковый периартериит, болезнь Кавасаки (поражение артерий среднего размера), васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, иммунокомплексные васкулиты (поражение мелких артерий), болезнь Бехчета (поражение сосудов различного калибра), а также васкулиты при системных заболеваниях (системная красная волчанка и другие ревматологические заболевания) и васкулиты, связанные с вероятной этиологией (гепатит С и В, сифилис, онкология, иммунные, лекарственные и др.) [5]. Васкулиты при инфекционных заболеваниях, связанные с воспалительными изменениями стенки сосудов вследствие инвазии в нее различных патогенных организмов, с которыми также дифференцируется ПВЦНС, в номенклатуру васкулитов не включены [3, 5—7]. ПВЦНС, так же как и прочие, представленные в номенклатуре, разделяются в зависимости от калибра пораженных сосудов: васкулиты крупных, средних и мелких сосудов [8—10].
Эпидемиологические данные
Распространенность васкулитов ЦНС с точностью неизвестна, поскольку их часто не распознают из-за неспецифичности клинических проявлений, отсутствия серологических маркеров воспаления, а также в связи с тем, что церебральная ангиография, магнитно-резонансная томография (МРТ) головного мозга и биопсия головного мозга могут давать ложноположительные и/или ложноотрицательные результаты. Данные об относительной частоте ПВЦНС и вторичных васкулитов с поражением ЦНС противоречивы. Одни авторы указывают, что частота ПВЦНС составляет 1,2% от всех васкулитов, поражающих ЦНС [11], и что они встречаются реже, чем системные васкулиты с поражением ЦНС [2, 7]. В отличие от этого данные клиники Mayo свидетельствуют о преобладании ПВЦНС среди всех васкулитов с поражением ЦНС [12].
К 1986 г. в англоязычной литературе было опубликовано всего 46 наблюдений ПВЦНС [13]. В последние годы благодаря совершенствованию инструментально-лабораторной базы, они распознаются чаще, чем ранее, особенно по сравнению со вторичными васкулитами, что отражается и в росте числа публикаций, посвященных ПВЦНС [2—4, 6—10, 14—23].
По данным клиники Mayo, располагающей наибольшим числом наблюдений ПВЦНС, верифицированных с помощью ангиографии или биопсии головного мозга (101 больной к 2007 г. и 163 больных к 2015 г.), его ежегодная частота у взрослых составляет 2,4 случая на 1 млн населения [10, 20]. Возраст больных в этой серии наблюдений, а также среди еще одной большой группы больных (102 пациента), описанных французскими исследователями [24], колебался от 17 до 85 лет, составляя в среднем 48 лет. M. Lucke и R. Hajj-Ali отмечают, что пик заболевания приходится на возраст 50 лет [22]. Заболевание встречается не только у взрослых, но и у детей [6, 25]. Гендерные различия в больших сериях наблюдений, представленных в литературе американскими и французскими исследователями, не были существенны: первые отмечали небольшое преобладание женщин (56%) [19], вторые — мужчин (53%) [17]. В отдельных небольших сериях больных, упомянутых в обзоре J. Birnbaum и D. Hellman, отмечено двукратное преобладание мужчин [4]. Среди детей ПВЦНС чаще встречается у мальчиков (62—74%) [25, 26]. M. Twilt и S. Benseler отмечают отличия гендерного распределения у детей в зависимости от калибра пораженных артерий: васкулит с поражением мелких артерий чаще встречается у девочек, с поражением средних и крупных артерий — у мальчиков [6].
История изучения ПВЦНС, критерии диагностики
Одни из первых описаний ПВЦНС были сделаны в 50-е годы прошлого столетия W. Newman, A. Wolf [27] и H. Cravioto, I. Feigin [28]. Так как методом верификации ПВЦНС было патоморфологическое исследование, заболевание считалось фатальным. В 80-е годы число публикаций значительно возросло благодаря широкому применению в клинике инвазивной контрастной ангиографии, позволившей верифицировать васкулиты по характерному признаку — чередованию участков сужения и расширения артерий. Большинство описанных случаев не были верифицированы патоморфологически, что в некоторых из них не исключало гипердиагностику [23].
В 1988 г. американские ревматологи L. Calabrese, J. Mallek [13] на основе анализа 8 собственных и 40 случаев, описанных в литературе, предложили следующие диагностические критерии ПВЦНС, поражающего мелкие артерии: 1) наличие неврологического или психического дефекта, необъяснимого другими причинами; 2) наличие классических ангиографических признаков (распространенные чередующиеся участки расширения и сужения мелких артерий) или гистопатологических проявлений ПВЦНС; 3) отсутствие признаков системного васкулита или любых других заболеваний, которые могли бы вызвать такую же ангиографическую картину.
К концу ХХ века стало очевидным, что случаи ПВЦНС с доброкачественным течением, благоприятным прогнозом и ангиографическими изменениями в виде чередующихся участков сужения и расширения в действительности могут представлять собой не васкулит, а невоспалительную обратимую церебральную ангиопатию [29, 30], для обозначения которой L. Calabrese и соавт. [31] предложили термин «обратимый церебральный вазоконстрикторный синдром» (англ.: reversible cerebral vasoconstriction syndrome — RCVS). Это основное заболевание, которое может имитировать ПВЦНС.
В первой декаде 2000-х годов было предложено разделять ПВЦНС в зависимости от калибра пораженных сосудов. Васкулиты мелких артерий также обозначаются как ангиографически негативные, поскольку их верификация возможна только при биопсии головного мозга. Васкулиты средних/крупных артерий — как ангиографически позитивные [8, 10, 15]. Необходимость такого разделения продиктована отличием их клинических проявлений, течения, диагностических и лечебных подходов. Следует отметить, что понятия васкулит мелких артерий и ангиографически негативный васкулит не всегда равнозначны, так как иногда васкулит мелких артерий верифицируется при контрастной ангиографии [19]. Согласно международной номенклатуре васкулитов, принятой в 2012 г. [5], к крупным артериям относятся аорта и ее ветви, к средним — основные висцеральные артерии и отходящие от них ветви, к мелким — интрапаренхиматозные артерии, артериолы, капилляры. Применительно к головному мозгу крупными считаются внутренняя сонная артерия (ВСА) и позвоночная артерия (ПА), средними — средняя (СМА), передняя (ПМА), задняя (ЗМА) мозговые артерии, базилярная артерия (БА) и их интракраниальные ветви, мелкими — внутримозговые сосуды. Вместе с тем необходимо отметить, что до настоящего времени нет единого подхода к оценке размера сосудов головного мозга, чем, очевидно, отчасти объясняются различия данных американских и французских исследователей.
Существенным прорывом в неинвазивной верификации васкулитов крупных и средних артерий стало использование высокоразрешающей МРТ с толщиной срезов не более 3 мм для оценки состояния артериальной стенки до и после введения контраста. С помощью этого метода T. Bley и соавт. в 2005 г. показали возможность выявления воспалительных изменений по накоплению контраста в стенке поверхностной височной артерии у больных с гигантоклеточным артериитом [32]. Причем чувствительность и специфичность МРТ и гистологических методов диагностики в этих случаях были сходными (около 80 и 100% соответственно). В 2007—2008 гг. W. Kuker и соавт. для верификации воспаления в крупных артериях мозга (интракраниальные отделы ВСА и ПА, начальные отделы СМА, ПМА, ЗМА и БА) предложили проведение мультипланарной высокоразрешающей МРТ в режиме Т1 с подавлением сигнала от жировой ткани до и после введения контраста, которая позволяет обнаружить утолщение артериальной стенки и накопление в ней контраста [33—35]. В 2010 г. T. Saam и соавт. предложили протокол проведения высокоразрешающей МРТ с подавлением сигнала не только от жировой ткани, но и от движущейся крови (режим Dark blood — черная кровь) для верификации васкулита интракраниальных и цервикальных артерий [36].
К настоящему времени наибольшее число больных (более 100 наблюдений) с ПВЦНС, поражающим сосуды разного калибра, обследованы в клинике Mayo (США) [19] и во Франции [16, 17]. Несмотря на накопившиеся новые данные и появившиеся диагностические возможности, критерии диагностики ПВЦНС, разработанные около 30 лет назад для мелких артерий, остаются прежними и используются для артерий разного калибра. Сложность и малоизученность проблемы ПВЦНС инициировали объединение усилий исследователей разных стран для проведения международного исследования [37].
Морфологические изменения при ПВЦНС
Выделяют 3 основных гистопатологических варианта ПВЦНС [38, 39]. Наиболее частым из них является гранулематозный васкулит, доля которого среди всех ПВЦНС составляет 58%. Он характеризуется наличием вокруг сосудов мононуклеарного воспаления в сочетании с образованием гранулем в разных слоях сосудистой стенки и наличием полинуклеарных клеток. Почти в 50% случаев отмечается отложение бета-амилоида в сосудистой стенке. Этот вид васкулита описывается как А-β — связанный ангиит (A-β-related angiitis — ABRA) [40]. Его необходимо дифференцировать от церебральной амилоидной ангиопатии (ЦАА) с периваскулярной воспалительной реакцией (моно- и полинуклеарные клетки), при которой гранулемы отсутствуют. Причина воспалительной реакции на отложение β-амилоида окончательно не ясна. J. Eng и соавт. предполагают, что фактором риска его развития является генотип APOE ε4/ε4 [41]. По мнению C. Giannin, взаимоотношение между ABRA и ЦАА с периваскулярной воспалительной реакцией — являются ли они самостоятельными или патогенетически связанными заболеваниями — не установлено [39].
Лимфоцитарный васкулит составляет 28% всех случаев ПВЦНС и характеризуется выраженной инфильтрацией сосудистой стенки лимфоцитами, а иногда и плазматическими клетками, что ведет к ее дезорганизации и деструкции. Наличие отдельных периваскулярных мононуклеарных клеток не является основанием для диагностики лимфоцитарного васкулита. Значительная лимфоцитарная инфильтрация вещества головного мозга при лимфоцитарном васкулите отсутствует [39].
Некротизирующий васкулит встречается в 14% случаев и обычно поражает небольшие артерии мышечного типа. Морфологически изменения напоминают таковые при узелковом полиартериите и характеризуются трансмуральным фибриноидным некрозом с деструкцией внутренней эластической мембраны. Некроз сосудистой стенки является причиной внутримозговых кровоизлияний и микроаневризм. Состояние сосудистой стенки при дифференциальном диагнозе васкулита с другими причинами острых некрозов или кровоизлияний в мозге должно оцениваться вне зон этих повреждений, так как в их пределах изменения сосудистой стенки носят вторичный характер и не являются признаком васкулита [39]. Ишемические изменения в биоптатах головного мозга при ПВЦНС обнаруживаются в 40—51% случаев, чаще всего при некротизирующем васкулите, кровоизлияния — в 12% [39]. Морфологические изменения при ПВЦНС, как правило, обнаруживаются в артериях небольшого и среднего калибра и артериолах, тогда как в венах они выявляются редко [11]. В отдельных случаях находят изолированное поражение вен небольшого и среднего калибра белого вещества полушарий головного мозга и его мягкой мозговой оболочки. В наблюдении J. Mlakar и соавт. оно было представлено гранулематозным воспалением вен в виде аккумуляции эпителиоидных макрофагов с лимфоцитами, расположенными по периферии гранулемы, и отдельными гигантскими клетками типа Лангерганса, рассеянными среди макрофагов и лимфоцитов. Поскольку эндотелий вен практически был интактен, предполагалось, что патогенный антиген, вызвавший воспалительную реакцию вокруг вен, распространялся со стороны их адвентиции [42] и имел сродство к венам.
Этиология и патогенез ПВЦНС
До настоящего времени этиология и патогенез остаются недостаточно изученными [22]. В литературе широко обсуждается роль инфекции, особенно учитывая частый гранулематозный и лимфоцитарный типы воспаления, выявляемые при морфологическом исследовании. В качестве этиологических факторов придается значение вирусу ветрянки (Varicella zoster virus — VZV) [43—45], вирусу Эпштейна—Барр [46], вирусу лихорадки Западного Нила [47] и вирусу иммунодефицита человека [48]. Необходимо подчеркнуть, что патогенные агенты исполняют роль провоцирующего фактора, приводящего к развитию иммунного воспаления в сосудистой стенке, и что ПВЦНС не относится к инфекционным васкулитам. Наиболее ярко это демонстрируется на примере вируса VZV. После перенесенной общей инфекции (ветряная оспа) вирус в латентной форме персистирует в тригеминальном и цереброспинальных ганглиях. При снижении иммунитета вирус активируется и трансаксонально может достигать стенки ВСА (из тригеминального ганглия) или ПА (из верхних цереброспинальных ганглиев), инициируя в них воспалительные изменения, в генезе которых определяющая роль принадлежит иммунным реакциям. Клиническим подтверждением роли VZV в поражении церебральных артерий является повышение частоты инсультов после перенесенной VZV-инфекции. Данные иммуногистохимического исследования, обнаружившие присутствие антигена VZV в адвентиции на начальных стадиях заболевания, а позже — в медии и интиме, также подтверждают роль трансаксонально распространяющегося VZV в поражении сосудистой стенки. Ее изменение представлено утолщением интимы, миоциты которой экспрессируют актин и миозин [45]. Подтверждением иммунных механизмов служит эффект от лечения кортикостероидами и иммуносупрессантами [21].
Значение иммунных механизмов в генезе ПВЦНС подчеркивается случаями его развития у больных с первичным и приобретенным иммунодефицитом. Предполагается, что определенное значение имеет система гистосовместимости классов I и II. Ее типирование у больной с изолированным васкулитом обеих ВСА обнаружило HLA-аллели, ассоциирующиеся с болезнью Такаясу (B52), болезнью Бехчета (В51), гигантоклеточным артериитом (DR 4), тогда как клинико-лабораторных признаков этих заболеваний у больной не было [49].
Фундаментальное значение в раскрытии триггерной роли вирусов и роли иммунной системы в развитии первичного васкулита крупных и средних артерий представляет работа C. Weyand и соавт., посвященная изучению механизмов развития воспаления в стенке крупных артерий на модели гигантоклеточного артериита, в генезе которого придается значение герпетической инфекции [50]. Отличительной чертой этих артерий является наличие в их адвентиции и медии дендритных клеток, которые осуществляют взаимодействие сосудистой стенки и иммунной системы. При васкулите они трансформируются, увеличиваются в количестве, распределяются по всей стенке и участвуют в прогрессировании заболевания. Предполагается, что стимуляция дендритных клеток осуществляется через Тoll-подобные рецепторы, причем в качестве стимула (локального или системного) рассматриваются различные инфекционные агенты. Стимуляция дендритных клеток вызывает активацию иммунной системы с притоком в артериальную стенку Т-клеток, преимущественно CD4 Т-клеток и макрофагов. Они проникают в стенку по собственным сосудам артерий (vasa vasorum), переходят в межклеточное пространство и направляются от адвентиции к интиме. В типичной ситуации высокоактивированные макрофаги, известные как гистиоциты, собираются в гранулемы, которые окружены Т-клетками. В месте повреждения сосудов при васкулите обнаруживается множество эффекторных цитокинов. Выделяют два основных кластера цитокинов, связанных с развитием воспаления сосудистой стенки и активностью заболевания. Для первого из них центром является ось IL-6/IL-17, для второго — IL-12/IFN-γ. Предполагается, что первый кластер связан с остротой процесса, учитывая его высокую чувствительность к кортикостероидной терапии. Активация второго кластера цитокинов ответственна за переход заболевания в хроническую стадию. Наблюдающаяся при этом активация макрофагов с выделением сосудистых ростковых факторов, металлопротеиназ вызывает деградацию экстраклеточного матрикса сосудистой стенки, усиливает провоспалительную активность эндотелия и пролиферацию гладкомышечных клеток. В сосудистой стенке IFN-γ запускает сигнальные пути миграции и пролиферации для гладкомышечных клеток, что приводит к сужению просвета сосуда гиперплазированной интимой, формированию неоваскулярной сети капилляров. IFN-γ может вызывать не только пролиферацию, но и апоптоз гладкомышечных клеток, т. е. исполнять роль сигнала, который разделяет гладкомышечные клетки на пролиферирующие и погибающие. Особенностью кластера цитокинов, связанных с Тh1-клетками, является его нечувствительность к стероидам и персистирование высокого уровня IFN-γ в крови, несмотря на иммуносупресантную терапию, что поддерживает хроническое воспаление. Дальнейшее изучение данных механизмов поможет выявить маркеры активности заболевания и эффективности проводимого лечения [50].
Клиническая картина
Клинические проявления ПВЦНС разнообразны и включают головную боль (51—65%), когнитивные нарушения (36%—54%), инсульты (40%), преходящие нарушения мозгового кровообращения (26%), эпилептические приступы (20—35%), снижение уровня бодрствования (26%), психические расстройства (22%), парезы конечностей (5%), снижение зрения (11%), отек дисков зрительных нервов (4%) [17, 19, 51]. Указанная симптоматика в 68% случаев развивается остро, в остальных — имеет постепенно прогрессирующее течение.
Первыми клиническими проявлениями у 71% больных являются инсульты, стойкий неврологический дефицит, головная боль и когнитивные нарушения [19]. Иногда заболевание дебютирует эпилептическими приступами [52].
Клинические проявления зависят от калибра пораженных сосудов. Отличительной особенностью васкулита мелких артерий, верифицированного при биопсии мозга, является более частое развитие когнитивных нарушений (67—71%), чем при поражении крупных/средних артерий, верифицированном при ангиографии (36—47%) [17, 19]. H. De Boysson и соавт. [17] отмечают также более молодой возраст больных с поражением мелких артерий (41,5 года против 48,5 года при поражении артерий среднего/крупного калибров), более частое развитие у них эпилептических приступов (77% против 21%), дискинезий (35% против 9%), снижения уровня бодрствования (42% против 21%). Отличительной особенностью клинических проявлений артериита крупных/средних артерий является более частое развитие преходящих нарушений мозгового кровообращения, инсультов, очаговых неврологических нарушений, частота которых достигает 50—88% [17, 19]. M. Lucke и R. Hajj-Ali обращают внимание на то, что нарушения мозгового кровообращения развиваются в разных сосудистых бассейнах и часто сочетаются с воспалительными изменениями в цереброспинальной жидкости (ЦСЖ) [22]. Наряду с неврологической симптоматикой у 10% больных, по данным клиники Mayo, отмечаются повышенная утомляемость, снижение аппетита, потеря массы тела, артралгии, а у 14% больных — повышение температуры [19].
Описания серии больных с васкулитом крупных артерий (ВСА, ПА), верифицированным накоплением контраста в их стенке, в литературе отсутствуют. Имеются лишь сообщения об отдельных пациентах, ишемические инсульты у которых имели тенденцию к рецидивам с развитием в пределах одной сосудистой системы (вертебрально-базилярной или каротидной) [49, 53]. На ранней стадии заболевания просвет артерий мог быть не стенозирован, тогда как при МРТ-исследовании выявлялось накопление контраста артериальной стенкой — признак ее воспалительных изменений [53]. После лечения стероидами одни авторы [53, 54] наблюдали исчезновение или уменьшение накопления контраста сосудистой стенкой, другие [49] отмечали его персистирование на протяжении 6 мес при положительном клиническом эффекте.
Среди ПВЦНС с поражением мелких артерий выделяют ангиит, характеризующийся отложением β-амилоидного пептида в мелких артериях коры и лептоменингеальной оболочке (ABRA) [19, 55]. Он развивается в более пожилом возрасте, чаще дебютирует когнитивными нарушениями и эпилептическими приступами, характеризуется повышением белка в ЦСЖ, частым накоплением контраста оболочками головного мозга при МРТ, хорошим эффектом от лечения стероидами (монотерапия или в сочетании с циклофосфамидом).
В рамках ПВЦНС, в основном поражающем мелкие артерии, выделяется опухолеподобная форма [15, 56]. Она развивается в более молодом возрасте (средний возраст 37 лет) и в 90% случаев проявляется эпилептическими приступами. МРТ обнаруживает одиночные или множественные очаги, накапливающие контраст, окруженные отеком и оказывающие объемное воздействие на смежные структуры головного мозга. Очень часто этот подвид ПВЦНС ошибочно рассматривается как опухоль или лимфома. Дифференциальной диагностике с опухолью помогает биопсия головного мозга и МР-спектроскопия. Лечение глюкокортикоидами в сочетании с циклофосфаном дает хороший эффект, однако у половины больных в последующем отмечаются рецидивы, требующие повторного курса лечения [56].
Течение ПВЦНС может быть как прогрессирующим, с повторными обострениями, так и монофазным. Среди 102 больных, описанных H. Boysson и соавт. [17], обострения заболевания происходили в трети случаев, причем чаще при поражении мелких, чем крупных артерий (54% против 24%). К. Maclaren и соавт. также указывают на более частые обострения при поражении мелких артерий [8]. Они происходили на фоне низких поддерживающих доз преднизолона или азатиоприна либо при отмене препаратов. В целом при поражении мелких артерий заболевание протекало тяжелее, с развитием энцефалопатии, проявляющейся когнитивными нарушениями и эпилептическими приступами, тогда как при поражении средних и крупных артерий обычно имелся очаговый неврологический дефицит, обусловленный инсультом. Функциональное состояние больных, по данным динамического наблюдения, продолжавшегося в среднем 53 мес, существенно не зависело от калибра пораженных артерий [17].
В отличие от данных H. Boysson и соавт. [17] C. Salvarani и соавт. [19—21] указывают на более тяжелое, быстро прогрессирующее течение заболевания у больных с двусторонними, множественными изменениями церебральных артерий по данным ангиографии и множественными инфарктами головного мозга на МРТ, тогда как при поражении мелких артерий течение заболевания более доброкачественное. Функциональный неврологический дефицит в среднем через год от дебюта заболевания был больше при васкулите, верифицированном ангиографически, чем при васкулите мелких артерий, включая амилоидассоциированный васкулит, встречающийся в более старшей возрастной группе.
Различия между данными французских и американских исследователей, возможно, связаны с селекцией больных, разной стандартизацией калибра артерий головного мозга (мелкие, средние, крупные), а также с преобладанием у больных, описанных H. Boysson и соавт., лимфоцитарного васкулита [17].
Как американские, так и французские исследователи указывают на зависимость течения заболевания, а именно частоты рецидивов, от проводимого лечения. Так, C. Salvarani и соавт. отметили меньшую частоту рецидивов, если в дебюте заболевания кортикостероиды сочетали с циклофосфаном, а не применяли как монотерапию (18% против 39%) [20]. H. Boysson и соавт. указывают на более редкие обострения и лучший функциональный исход, если после лечения в острой стадии заболевания продолжается поддерживающая терапия [24].
У 10% больных ПВЦНС имеет катастрофическое течение, для которого характерно быстрое, в течение нескольких дней снижение уровня бодрствования и появление дыхательных нарушений. Если в течение первых недель не наступает летальный исход, функциональное состояние больных к концу лечения не отличается от такового при менее тяжелом течении заболевания [57].
Диагностика ПВЦНС
Она основывается на описанных выше критериях, предложенных в 1988 г. L. Calabrese и J. Mallek [13]. Несмотря на успехи, достигнутые в изучении ПВЦНС, его диагностика до настоящего времени представляет значительные трудности. На это указывает длительный временной интервал (170 дней) между дебютом заболевания и его диагностикой [14]. Диагностические трудности во многом связаны отсутствием специфичных и чувствительных лабораторно-инструментальных тестов, в связи с чем большое значение имеет комплексная оценка клинико-лабораторно-инструментальных данных.
Исследование крови. Специфичные и чувствительные для ПВЦНС серологические маркеры отсутствуют [15]. В наиболее многочисленных сериях ПВЦНС, представленных в литературе, у 18% больных отмечено повышение скорости оседания эритроцитов (СОЭ), у 27—33% — повышение С-реактивного белка, обычно небольшое. Ревматоидный и антинуклеарный факторы, антинейтрофильные цитоплазматические антитела (АНЦА), антитела к экстрагированному ядерному антигену, комплимент, криоглобулины, волчаночный антикоагулянт, ВИЧ были отрицательными или в пределах нормы [16, 19]. Среди небольших групп больных с ПВЦНС в отдельных случаях отмечали небольшое, диагностически незначимое повышение АНЦА и антинуклеарного фактора [8, 51].
Исследование ЦСЖ. Небольшой лимфоцитарный плеоцитоз и/или умеренное повышение белка обнаруживают у 69—94% [10, 15, 17, 22, 51]. Чаще всего изменения выявляют при поражении мелких, чем крупных сосудов [17, 19, 51]. Так, H. de Boysson и соавт. [17] выявили их у 91% больных с васкулитом мелких артерий и 62% больных с поражением крупных/средних артерий. C. Salvarani и соавт. [19] обнаружили повышение белка более 45 мг/дл или лейкоцитов более 5 клеток/мл у 81% пациентов. Более выраженное изменение ЦСЖ отмечено при васкулите мелких артерий, чем крупных (цитоз 16 клеток по сравнению с 4 клетками; белок — 98 мг/дл по сравнению с 56 мг/дл соответственно). Синтез олигоклональных антител S. Schuster и соавт. [51] обнаружили у 35% больных. Исследование ЦСЖ на различные инфекционные агенты с помощью иммуноферментного анализа и полимеразной цепной реакции (ПЦР), а также цитологическое исследование для исключения метастатического поражения не выявляют изменений [15]. F. Pagni и соавт. описали больного с васкулитом спинного мозга, верифицированным на секции, у которого при исследовании ЦСЖ методом ПЦР было найдено большое число копий вируса Эпштейна—Барр при отсутствии признаков острой или хронической инфекции, обусловленной этим вирусом [46].
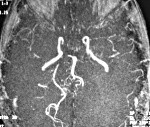
Церебральная ангиография является одним из методов верификации ПВЦНС. Характерные изменения представлены распространенными чередующимися участками сужения и расширения артерий, как правило, двусторонними, окклюзией отдельных сосудов, замедлением времени прохождения контраста, неоваскуляризацией, микроаневризмами, ранним заполнением венозного русла, обеднением дистальных отделов сосудистых бассейнов. Необходимо иметь в виду, что основной ангиографический признак васкулита — чередование участков сужения и расширения артерий — неспецифичен и может наблюдаться при спазме артерий, отеке сосудистой стенке, пролиферации ее клеточных элементов, в связи с чем большое значение имеет комплексный анализ ангиографических и клинических данных. Кроме того, характерные для ПВЦНС изменения выявляются в артериях среднего и крупного калибра, тогда как разрешающие способности ангиографии не позволяют обнаружить их в мелких артериях (менее 0,2 мм) [58].
Среди 129 больных с васкулитом, обследованных в клинике Mayo, изменения при ангиографии были найдены в 88% случаев, причем в 96% из них изменения были двусторонними. Частота и распространенность поражения зависели от калибра пораженных сосудов. Поражение крупных артерий (интракраниальный отдел ВСА и ПА, проксимальные отделы СМА, ПМА, ЗМА, БА) выявлялось реже (66%), чем поражение артерий меньшего калибра (дистальные отделы интракраниальных артерий и их ветви второго порядка) (91%). Кроме того, поражение крупных артерий реже было двусторонним (55%) по сравнению с артериями меньшего размера (91%) [19].
Нейровизуализация. Изменения вещества головного мозга, выявляемые при МРТ у больных с ПВЦНС, неспецифичны. Они включают корковые и субкортикальные инфаркты, внутримозговые кровоизлияния, накопление контраста оболочками мозга или внутримозговыми очагами, участки повышенной интенсивности сигнала в режиме Т2 или FLAIR [59, 60]. В 5% случаев выявляются изменения в спинном мозге, чаще всего в грудном отделе [60]. При псевдотуморозной форме ПВЦНС обнаруживаются очаги, иногда с зонами некроза, перифокальным отеком, объемным воздействием на смежные структуры, которые накапливают контраст и нередко ошибочно трактуются как злокачественные опухоли или абсцесс [15, 60]. Частота опухолеподобных очагов при ПВЦНС, по данным G. Boulouis и соавт., составляет 12% [61].
По данным клиники Mayo, инфаркты головного мозга при МРТ были найдены у 54% из 149 обследованных больных с ПВЦНС [19]. Чаще их выявляли при ангиографически верифицированном васкулите, т. е. при поражении артерий среднего и крупного размера (66%), чем при васкулите, подтвержденном биопсией, т. е. при поражении мелких артерий (34%). Сходные данные получены S. Schuster и соавт. [51]: инфаркты головного мозга были найдены в 85,7% случаев при поражении крупных артерий, в 29,4% случаев при поражении мелких. C. Thaler и соавт. также указывают на типичность развития инфарктов головного мозга при поражении артерий среднего и крупного калибра: в этом случае они были выявлены у 19 из 25 больных, чаще всего в бассейне СМА, в отличие от этого инфаркты отсутствовали у всех 8 больных с поражением мелких артерий [62]. G. Boulouis и соавт. обнаружили при МРТ головного мозга множественные, двусторонние инфаркты, преимущественно в системе сонных артерий у 42% из 60 больных с ПВЦНС, верифицированным биопсией или ангиографически. В 55% случаев выявляли геморрагические инфаркты и паренхиматозные кровоизлияния, в 26% — острые конвекситальные субарахноидальные кровоизлияния [61].
Почти у всех больных наряду с инфарктами головного мозга при МРТ в режиме Т2 и FLAIR в белом веществе головного мозга обнаруживаются гиперинтенсивные очаги, трактовка которых вызывает диагностические трудности [15, 51].
Накопление контраста очагами или оболочками головного мозга чаще отмечено при васкулите мелких (60—77%), чем крупных (22—29%) артерий [19, 51, 61].
Редкой нейровизуализационной находкой среди больных, описанных S. Schuster и соавт., была выраженная атрофия головного мозга, в основе которой согласно данным биопсии лежало трансмуральное воспаление очень мелких сосудов [51].
При изолированном поражении церебральных вен небольшого и среднего калибра, верифицированном на секции, МРТ головного мозга в режиме Т2 и FLAIR обнаруживает линейной формы гиперинтенсивность в проекции вен и перивенозных пространств белого вещества полушарий головного мозга [42].
Характерными нейровизуализационными признаками амилоидассоциированного ангиита с периваскулярным воспалением, отличающими его от ЦАА, является накопление контраста мягкой мозговой оболочкой с сопутствующим инфильтративным изменением белого вещества полушарий головного мозга или без него (70% против 7%), а также более редкое развитие лобарных кровоизлияний (7% против 62%) [63].
Нейровизуализационное исследование в режиме ангиографии (МРА и КТА) может выявлять чередующиеся участки сужения и расширения артерий с гладкими или неровными контурами, дву- или односторонние. Результаты исследования артерий головного мозга с помощью МРА и КТА зависят от разрешающей способности используемого оборудования. Если ранее считалось, что МРА практически не имеет диагностической значимости, то согласно данным, опубликованным в 2017 г., изменения интракраниальных артерий при МРА были выявлены в 77% случаев [61]. Несмотря на улучшение разрешающей способности МРА, ее диагностические возможности меньше, чем у инвазивной контрастной ангиографии [60, 61]. Необходимо иметь в виду неспецифичность этих изменений, в связи с чем диагноз должен основываться на комплексной оценке клинических, лабораторных и ангиографических данных [15].
Исследование сосудистой стенки ВСА, ПА, СМА, ПМА, ЗМА, БА с помощью высокоразрешающей МРТ в режиме подавлением сигнала от жировой ткани и движущейся крови до и после введения контраста при толщине срезов не более 3 мм в больших сериях больных с ПВЦНС не проводилось [33—36]. В литературе описаны лишь отдельные больные, у которых при этом исследовании выявлено накопление контраста артериальной стенкой — признак ее воспалительных изменений [49, 51, 53, 54]. Накопление контраста артериальной стенкой в некоторых случаях уменьшалось или исчезало в среднем через 7 мес, в других — персистировало на протяжении более года, что, по-видимому, связано с разным ответом на проводимое лечение [36, 64, 65]. H. Noh и соавт. [53] подчеркнули, что накопление контраста может выявляться на ранней стадии ПВЦНС, когда явные изменения просвета артерии отсутствуют и контрастная ангиография дает негативные результаты. K. Ohno и соавт. [54] пришли к заключению, что феномен накопления может использоваться не только для верификации воспаления артериальной стенки, но и для мониторирования активности заболевания: после лечения кортикостероидами и микофенолатом мофетилом 2 детей с ПВЦНС и ишемическими инсультами, обусловленными стенозами СМА и ВСА, накопление контраста их стенкой значительно уменьшилось. Вместе с тем K. Fukuma и соавт. отметили, что накопление контраста артериальной стенкой не всегда свидетельствует об активности воспалительного процесса: они наблюдали его персистирование в стенке ВСА, несмотря на улучшение сигнала от кровотока по СМА и ПМА после лечения стероидами [49]. E. Obusez и соавт. полагают, что длительно персистирующее накопление контраста артериальной стенкой на фоне лечения может быть связано не с текущим воспалением, а с поствоспалительным повреждением эндотелиальных контактов [65].
Накопление контраста в артериальной стенке обнаруживается не только при ПВЦНС, но и при постветряночной васулопатии, саркоидозе, гигантоклеточном артериите, ревматологических заболеваниях, сифилисе, боррелиозе [33, 34, 66, 67]. Кроме того, умеренное накопление может наблюдаться при атеросклерозе, болезни моямоя и диссекции магистральных артерий головы [64].
Ультразвуковое исследование (УЗИ) экстракраниальных артерий с введением контраста. Данное исследование с введением специального контраста