сульфасалазин и метотрексат что лучше при ревматоидном артрите
Лечение ревматоидного артрита: тактические вопросы в практике клинициста
Течение ревматоидного артрита (РА) весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно.
Течение ревматоидного артрита (РА) весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно. Диагностические критерии, предложенные Американским колледжем ревматологов (ACR) в 1987 году, не отвечают требованиям ранней диагностики РА. Поэтому в последние годы совместными усилиями Европейской антиревматической лиги (EULAR) и ACR разрабатываются новые критерии, ориентированные на как можно более раннее установление диагноза РА. Известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания.
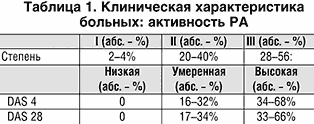
В крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) [1] (рис. 1). Морфологическое исследование синовиальной оболочки, полученной при биопсии у больных в первые месяцы после дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у большей части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [2]. Таким образом, даже в дебюте развития суставного поражения болезнь может представлять хроническую стадию. Поэтому задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) ухудшает отдаленный прогноз РА, как функциональный, так и жизненный. Для новых диагностических критериев EULAR/ACR выбраны четыре группы параметров, а каждый параметр на основании многомерного статического анализа получил балльную выраженность (табл. 1), при сумме баллов 6 и более устанавливается определенный диагноз РА.
В последние годы постоянно обсуждается вопрос, когда врач имеет право назначить БПВП. В соответствии с рекомендациями Ассоциации ревматологов России [3] основной группой препаратов для лечения РА (категория доказательности А) являются метотрексат и другие широко назначаемые препараты — лефлуномид и сульфасалазин, БПВП следует назначать как можно раньше (в пределах 3–6 месяцев от первого появления симптомов), даже если пациенты формально не соответствуют диагностическим критериям 1987 г. В рекомендациях Европейской антиревматической лиги (EULAR) 2007 года [4] указывается, что при риске развития персистирующего эрозивного артрита, даже если больной не отвечает классификационным критериям РА, показано назначение БПВП. Первым должен назначаться метотрексат, а при невозможности его назначения препаратами первой линии считаются лефлуномид, сульфасалазин и соли золота [4]. По рекомендациям ACR 2008 года [5] БПВП должны назначаться как можно раньше после дебюта симптомов артрита и препаратами первой линии считаются метотрексат и лефлуномид.
Далее во всех современных рекомендациях обращается внимание, что тактика лечения больного РА зависит от адекватности (или неадекватности) лечения. Таким образом, перед клиницистом стоят три задачи: выбор препарата, оценка адекватности терапии на ее этапах и своевременная коррекция лечения.
Последние рекомендации ACR (2008) [5] по лечению больных РА БПВП и ГИБП включают в себя определение основных параметров, которые следует учитывать при назначении препаратов. К ним относятся:
Н. В. Чичасова, доктор медицинских наук, профессор
МГМУ им. И. М. Сеченова, Москва
Метотрексат в лечении ревматоидного артрита и псориатического артрита

В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективнос
Abstract. The article provides data on the place of methotrexate in accordance with international and national recommendations 2019–2020 in the management of patients with rheumatoid and psoriatic arthritis. Data on the prevalence of these diseases, the effectiveness and tolerability of methotrexate according to randomized controlled and cohort studies are presented. The advantages of the subcutaneous form of methotrexate in terms of efficacy and tolerability for both rheumatoid and psoriatic arthritis are discussed. Data on the tolerance of the subcutaneous form of methotrexate from various manufacturers are presented. Analysis of literature data and the results of our own research indicate the need for early prescription of methotrexate in patients with rheumatoid arthritis and patients with peripheral joint lesions in psoriatic arthritis. Numerous studies confirm the effectiveness of methotrexate in rheumatoid arthritis in relation to the symptoms of the disease, both articular and non-articular, structural damage (slowing down X-ray progression), which is accompanied by an improvement in the patient’s functional abilities. With psoriatic arthritis, methotrexate is able to reduce the activity of arthritis, enthesitis, reduce skin manifestations, and improve the functional state of the patient. Treatment with methotrexate, when the clinical effect is achieved, is accompanied by a decrease in cardiovascular complications in inflammatory lesions of the joints.
Резюме. В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективности и переносимости метотрексата по данным рандомизированных контролируемых и когортных исследований. Обсуждаются преимущества подкожной формы метотрексата в отношении эффективности и переносимости как при ревматоидном, так и при псориатическом артрите. Представлены данные по переносимости подкожной формы метотрексата различных производителей.
Анализ данных литературы и результаты собственных исследований свидетельствуют о необходимости раннего назначения метотрексата больным ревматоидным артритом и больным с поражением периферических суставов при псориатическом артрите.
Многочисленные исследования подтверждают эффективность метотрексата при ревматоидном артрите в отношении симптомов болезни, как суставных, так и не суставных, структурных повреждений (замедление рентгенологического прогрессирования), что сопровождается улучшением функциональных способностей больного. При псориатическом артрите метотрексат способен уменьшить активность артритов, энтезитов, уменьшить кожные проявления, улучшить функциональное состояние больного. Лечение метотрексатом при достижении клинического эффекта сопровождается уменьшением кардиоваскулярных осложнений при воспалительном поражении суставов.
Ревматоидный артрит (РА) и псориатический артрит (ПсА) являются одними из наиболее частых ревматических заболеваний, протекающих с поражением синовиальных суставов, а ПсА еще и с частым вовлечением в патологический процесс суставов позвоночника, энтезисов (мест прикрепления сухожильно-связочного аппарата сустава к кости). Распространенность РА среди взрослого населения колеблется от 0,5% до 1% и ПсА — от 0,05% до 1,2% [1, 2]. По данным Российского эпидемиологического исследования (проскринировано 76 162 человека, из них 4894 человека были осмотрены ревматологом) распространенность РА в РФ составила 0,6% и ПсА — 0,37% [3]. Объединяет эти два заболевания развитие периферического артрита, что и позволяет обсуждать медикаментозную терапию РА и данного субтипа ПсА в одной статье. При этом надо отметить, что ведение больных и вопросы безопасности фармакотерапии при РА и ПсА различаются в первую очередь из-за различий в структуре и частоте коморбидных состояний. При РА спектр коморбидности соответствует таковой в популяции, так что чаще всего имеют место кардиоваскулярные (КВ) заболевания (ИБС, артериальная гипертензия) и сахарный диабет (СД) преимущественно 2 типа, хотя риск развития КВ-заболеваний при РА выше, чем в популяции [4, 5]. При ПсА частота КВ-заболеваний высока, СД 1 типа, метаболический синдром и ожирение по многочисленным сообщениям встречаются чаще, чем в популяции, относительный риск развития СД 2 типа составляет 2,18 (95% доверительный интервал 1,36–3,50) [6–8]. Пациенты с ПсА имеют больший индекс массы тела (ИМТ), чем больные РА, и больше, чем в популяции [9], часто выявляется дислипидемия [10].
Метотрексат в лечении РА
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [11] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. В соответствии с международными и отечественными рекомендациями терапия синтетическими классическими базисными противовоспалительными препаратами (БПВП) должна начинаться сразу после установления диагноза (желательно в первые 3–6 месяцев от дебюта РА) [1, 12]. По данным анализа 14 рандомизированных контролируемых исследований (РКИ), в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА (с учетом пола, возраста, клинических и лабораторных параметров активности болезни), по мере увеличения длительности болезни частота развития эффекта БПВП снижалась с 52% (начало терапии в 1-й год болезни) до 35% (длительность РА > 10 лет) больных, ответивших на терапию [13].
«Якорным» препаратом из группы БПВП в лечении РА с конца прошлого столетия является метотрексат (МТ), поскольку он эффективен у большинства больных РА, обладает хорошей переносимостью доз, используемых в ревматологии при ограниченных противопоказаниях (острая инфекция, алкоголизм, беременность) (рис. 1) [14, 15]. МТ при РА может применяться в виде монотерапии, в комбинации с другими синтетическими (классическими и таргетными) БПВП или с генно-инженерными биологическими препаратами (ГИБП). В виде монотерапии (с или без глюкокортикоидов) МТ эффективен в первой линии фармакотерапии с уменьшением активности РА до низкой у 70% больных [16].
Перед назначением МТ следует оценить факторы риска нежелательных лекарственных реакций (НЛР): прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липиды, тест на беременность, маркеры вирусных инфекций — ВИЧ, гепатиты В/С), провести рентгенографию органов грудной клетки. Оптимальными терапевтическими дозами при лечении хронических воспалительных артритов считаются от 10–15 до 25–30 мг/неделю [17]. С учетом антифолатного действия МТ показана комбинация его с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту НЛР [18]. Начинают лечение с дозы 10–15 мг/неделю с увеличением ее на 2,5–5,0 мг каждые 2–4 недели с ориентацией на эффективность и переносимость [1]. В отечественных рекомендациях указано, что при наличии у больного РА высокой активности (т. е. те больные, которым показано использование дозы МТ ≥ 15 мг/неделю) рекомендуется начинать лечение с подкожной формы МТ. Известно, что биодоступность подкожной формы МТ выше, чем пероральной, особенно при назначении рекомендуемых высоких доз МТ и их быстрой эскалации [19]. В табл. приведено соотношение доз таблетированного МТ и МТ для подкожного введения. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 2) [20]. Объясняется это особенностями фармакодинамики различных форм МТ. При назначении МТ перорально препарат абсорбируется в проксимальном отделе тощей кишки при посредстве транспортера (PCFT/SLC46A1), что редуцирует фолаты и МТ [21]. Биодоступность орального МТ относительно высока, но варьирует в широких пределах у пациентов и снижается при увеличении дозы, выходя на плато при дозе 15 мг/неделю за счет сатурации интестинального транспорта [19, 20, 22]. При этом концентрация в плазме МТ при подкожном введении продолжает нарастать и при увеличении дозы выше 15 мг/неделю [19].
Результаты многих исследований показали большую эффективность подкожного введения МТ по сравнению с таблетированной формой в равных дозах и возможность достоверного увеличения эффекта в тех случаях, когда оральный препарат был неэффективен или недостаточно эффективен (рис. 3) [23–26]. Подкожная форма МТ лучше переносится, чем оральная. При появлении НЛР со стороны желудочно-кишечного тракта (ЖКТ) или печени показан перевод больного на подкожное введение, что позволяет уменьшить нежелательные проявления или купировать их, а это сопряжено с сохранением (нарастанием) эффекта, увеличивает выживаемость терапии и позволяет избежать или отсрочить назначение дорогостоящей терапии ГИБП [27, 28]. Данные исследования MENTOR (Methotrexate Evaluation of Norwich Treatment Outcomes in RA) оценили эффект перевода больных с орального на подкожный МТ в краткосрочный, средний и долговременный (до 5 лет наблюдения) периоды из-за непереносимости (43,9% больных) или из-за неэффективности (50,5% больных) в когорте из 196 пациентов с длительно текущим РА [29]. Смена формы МТ привела и к увеличению выживаемости терапии (83% больных продолжили лечение в течение 1 года, 75% — в течение 2 лет и 47% — в течение 5 лет) с минимальной потребностью в терапии ГИБП (10% больных). Метаанализ подтвердил преимущества подкожного МТ перед оральной формой в отношении и эффективности, и переносимости [30]
Особенно эффективно назначение подкожного МТ при раннем РА. Это показано на примере когорты St. Gallen [31] — 70 больным терапия подкожным МТ была инициирована без использования оральной формы. Через 1,8 года 53% больным не потребовалось присоединение ГИБП, а 47% больным ГИБП были присоединены через 387 ± 404 дня. Частота достижения низкой активности или ремиссии РА была несколько меньше в группе комбинированной терапии МТ + ГИБП, чем в группе, получавшей только МТ (низкая активность у 78,8% vs 81,1%; ремиссия — 69,7% vs 75,7%).
По нашим данным, назначение подкожного МТ (без использования оральной формы и без комбинации с глюкокортикоидами) 67 больным РА с исходно высокой и умеренной активностью болезни в первые полгода заболевания позволяет во всех случаях в течение 6–12 месяцев достичь ремиссии (в ряде случаев безлекарственной) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного при отмене из-за непереносимости (flu-синдром) у 2 больных (3%) [32].
Такие же данные получены сотрудниками Научно-исследовательского института ревматологии им. В. А. Насоновой [33] в исследовании РЕМАРКА: 191 больному была назначена подкожная форма МТ (без использования оральной формы) в начальной дозе 15 мг/неделю с эскалацией дозы до переносимой за 4–8 недель, что позволило добиться ремиссии у 54,1% больных за первый год лечения без применения глюкокортикоидов (ГК) и ГИБП.
Интересны данные Клиники раннего артрита (г. Лейден, Нидерланды) [34]: безлекарственной ремиссии удалось достичь у 155 из 1007 пациентов с РА (15,4%), диагноз которым был установлен с 1993 по 2011 г. За последние годы изменились тактика и стратегия лечения больных РА. Авторы установили, что стратегия ведения больных достоверно ассоциируется с достижением ремиссии (p
* ФГБНУ НИИР им. В. А. Насоновой, Москва, Россия
** ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Метотрексат в лечении ревматоидного артрита и псориатического артрита/ Н. В. Чичасова, А. М. Лила
Для цитирования: Лечащий врач № 7/2020; Номера страниц в выпуске: 42-51
Теги: суставы, воспаление, боль, осложнения
Ревматоидный артрит: кому и чем угрожает хронический недуг?
Это хроническое заболевание суставов встречается в основном у женщин, а его пик припадает на возраст 45-65 лет. Если болезнь не лечить, уже через несколько лет человек рискует потерять трудоспособность, и восстановиться будет невозможно. Как вовремя обнаружить прогрессирующее разрушение сустава и предотвратить осложнения?
Женщины 45-65 лет – в группе риска по ревматоидному артриту
Почему развивается ревматоидный артрит
Причина ревматоидного артрита – не только генетическая предрасположенность. Иногда к воспалительным процессам в суставе и соединительной ткани приводят инфекции и вирусы – герпес, гепатит В, корь, паротит. Если в организме есть патологический агент, достаточно одного или нескольких неблагоприятных факторов, чтобы в подвижных сочленениях запустился процесс деградации. Спусковым механизмом для артрита могут стать интоксикация, переохлаждение, чрезмерное количество солнечного света, стрессы и другие негативные обстоятельства.
При ревматоидном артрите иммунная система вырабатывает антитела, которые борются не с чужеродными, а со здоровыми клетками и тканями. Так в суставе возникает воспаление, синовиальная оболочка утолщается и становится плотной. По мере увеличения она повреждает хрящ, что приводит к ослаблению мышц, сухожилий и связок. Воспаленный сустав разрушает кости. Внешне он может выглядеть как при артрозе, но механизм утолщения здесь совершенно другой, чем остеофиты.
Вирус герпеса в организме – одна из причин ревматоидного артрита
Как он проявляется
Воспалительный процесс затрагивает сначала мелкие суставы – кисти и стопы, со временем поражает и крупные. Суставы повреждаются симметрично. В отличие от артроза колена, плеча или локтя, боль после нагрузки не усиливается, а наоборот затихает. Симптомы проявляются волнообразно: острые болевые приступы сменяются затишьем. Заболевание начинается с утренней скованности, а заканчивается без лечения – деформацией сустава.
Характерные симптомы болезни – покраснение и припухлость в области сустава, местное повышение температуры. Человек испытывает общую слабость и недомогание, поражаются внутренние органы, развиваются другие осложнения.
Сустав отекает? Обратитесь к ревматологу
Чем угрожает ревматоидный артрит
Заболевание очень коварно, поскольку может дать серьезные осложнения на системы организма:
Ревматоидный артрит осложняет протекание сопутствующих патологий
Как ставят диагноз
Ревматоидный артрит имеет схожую симптоматику с рядом других заболеваний суставов. Даже при артрозе с синовитом также присутствует припухлость, при этом болезнь имеет совершенно другую природу. Поэтому, чтобы поставить точный диагноз, жалоб пациента и визуального осмотра недостаточно. Один из характерных признаков ревматоидного артрита – наличие утренней скованности в течение часа и дольше, а также припухлость в течение периода более шести недель.
На этапе диагностики назначают такие обследования:
Рентген сустава поможет отличить ревматоидный артрит от артроза
Тактика лечения ревматоидного артрита
Как только диагноз перестает вызывать сомнения, назначают противоревматологические препараты, например метотрексат. Терапия направлена на то, чтобы сдержать болезнь, предупредить костные деформации и сделать прогноз развития благоприятным. Препарат подбирает врач-ревматолог индивидуально – для каждого пациента. Иногда лечение становится пожизненным.
Если противоревматологические препараты не справляются, назначают глюкокортикоидостероидные средства с мощным противовоспалительным действием. При их низкой эффективности следующий шаг – генно-инженерные биологические препараты.
Кроме медикаментозной терапии, пациентам рекомендуют лечебную физкультуру, которая показана на всех этапах развития болезни. В период ремиссии хорошо помогают улучшить состояние суставов массаж, гидротерапия и другие физиотерапевтические методы.
Если ревматоидный артрит перешел в запущенную стадию и консервативное лечение не помогает, прибегают к хирургии, чтобы восстановить функции конечностей. Вариантов операций несколько: удаление из пораженного сустава синовиальной жидкости (синовэктомия), оперативное вмешательство на костях, сухожилиях, связках (пластика), тотальное эндопротезирование сустава.
Как проявляется ревматоидный артрит и какие методы лечения использует современная медицина?
Ревматоидный артрит протекает сложно и часто приводит к тяжелым последствиям. Но самое неприятное – это необходимость регулярной медикаментозной терапии, без которой суставы быстро деградируют и теряют работоспособность. При артрозе держать заболевание под контролем гораздо проще. Достаточно периодически проходить курсы внутрисуставных инъекций синовиальной жидкости, чтобы восполнять ее дефицит, – и в периоды ремиссии, которые длятся по 1-1,5 года, можно вести полноценный образ жизни.
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
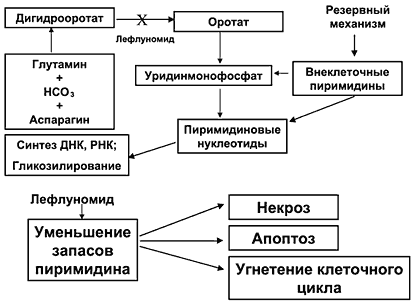
Данный взгляд на патогенез РА направил усилия ученых на создание лекарств, способных регулировать пролиферацию активированных Т–клеток. Таким новым средством базисной терапии является лефлуномид (Арава) (производства фармацевтической компании Aventis, Германия), созданный специально для лечения РА. Лефлуномид угнетает синтез пиримидина de novo, ингибируя фермент дегидрооротатдегидрогеназу, необходимую для синтеза уридинмонофосфата (рис. 1). Снижение синтеза пиримидиновых нуклеотидов приводит к торможению пролиферации активированных Т–клеток в фазе G1 клеточного цикла [3] и к изменению Т–клеточного аутоиммунного ответа; подавляется синтез провоспалительных цитокинов (интерферона g и ФНО- a ), уменьшается Т–зависимый синтез антител В–клетками [4]. Под влиянием лефлуномида происходит угнетение фактора транскрипции NF–k b [5] (фактор, необходимый для активации генов, кодирующих синтез провоспалительных медиаторов), угнетение ЦОГ–2 [6], синтеза молекул адгезии [7], повышение продукции цитокина TGF b [8], блокирующего пролиферацию Т– и В–лимфоцитов. Таким образом, угнетая образование Т–лимфоцитов, лефлуномид влияет и на продукцию антител и ряда цитокинов, и на процессы клеточной адгезии.
Рис. 1. Влияние на синтез пиримидина de novo
Клиническая эффективность и базисные свойства лефлуномида в отношении РА подтверждены рядом мультицентровых рандомизированных контролируемых испытаний, сравнивавших лефлуномид с плацебо, метотрексатом и сульфасалазином [9].
По химической структуре лефлуномид – низкомолекулярное (270 Д) производное изоксазола. В желудочно–кишечном тракте и в плазме лефлуномид быстро превращается в активный метаболит малононитриламид (А77 1726), который на 99,38% связывается с белками плазмы. Период полувыведения препарата составляет от 14 до 18 дней. Выводится лефлуномид через почки и желудочно–кишечный тракт в равных соотношениях [10,11]. Побочные эффекты при лечении лефлуномидом наблюдаются у і 5% пациентов и носят преимущественно легкий или умеренный характер [10,12]. По современным данным, использование лефлуномида не сочетается с повышенным риском возникновения злокачественных новообразований [13]. В сентябре 1998 г. лефлуномид был одобрен Министерством пищевой и лекарственной промышленности США для использования при РА; с этого времени в мире насчитывается более 200000 пациентов, принимающих препарат для лечения РА [14].
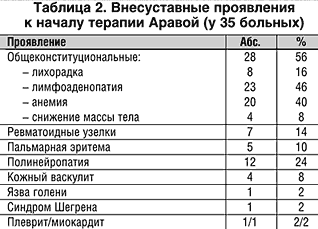
В нашей стране Арава зарегистрирована недавно и большинство врачей не имеют собственного опыта лечения больных РА. В данном сообщении мы представляем результаты лечения Аравой 50 больных РА с достоверным диагнозом по критериям ACR (1987 г.). Эта группа больных была представлена преимущественно женщинами (46 больных); преобладали пациенты серопозитивные по ревматоидному фактору (РФ) – (42 пациента); средний возраст составил 54,5±12,4 года; у 30% больных длительность РА к моменту назначения Аравы была менее 3–х лет, у 46% – 4–10 лет и у 24% – более 10 лет. У 70% больных регистрировалась III–IV рентгенологические стадии. За исключением 2 больных активность РА была II–III степени (табл. 1), а по критериям Европейской антиревматической лиги с использованием индекса активности болезни (Disease activity score – DAS) все больные были с умеренной и высокой активностью РА. Внесуставные проявления к началу терапии были у 35 больных (70%) и представлены в таблице 2.
Препарат назначался по стандартной схеме: первые 3 дня по 100 мг/сутки, далее по 20 мг/сутки. Доза временно уменьшалась у некоторых больных до 10 мг/сутки при появлении реакций непереносимости. Эффективность Аравы оценивалась по влиянию на показатели активности и прогрессирования РА. Оценивались выраженность суставного синдрома (количество болезненных и воспаленных суставов, интенсивность боли и общее состояние здоровья по визуальной аналоговой шкале, индекс Ritchie), продолжительность утренней скованности, функциональное состояние больных (тест Lee, опросник состояния здоровья – HAQ), рентгенологическое прогрессирование оценивалось по модифицированному нами методу Шарпа [20] с подсчетом количества эрозий в кистях и стопах и степени сужения суставной щели; для оценки темпа прогрессирования деструкции и сужения суставных щелей использовали коэффициент прогрессирования (Кпр.). Наличие и динамику внесуставных проявлений оценивали клинически и с использованием рентгенологических и ультразвуковых методов. Лабораторно оценивали СОЭ, СРБ, а также биохимические, клинические показатели крови и анализы мочи.
Клинико–лабораторный эффект Аравы развился у 47 из 50 больных (94%). Как видно из диаграммы, представленной на рисунке 2, все оцениваемые параметры суставного синдрома с высокой степенью достоверноcти уменьшались через 6 и еще в большей степени – через 12 месяцев лечения (p Рис. 2. Динамика средних показателей суставного синдрома
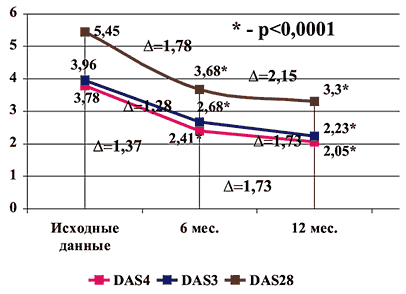
Оценивая динамику индекса активности болезни (DAS) в различной его модификации [16,17,18,19] – DAS 3, DAS 4, DAS 28 (рис. 3), можно увидеть, что Арава и через 6, и через 12 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (по критериям EULAR уменьшение индекса активности на 1,2 балла и более соответствует хорошему эффекту терапии). Так что через 6 месяцев лечения Аравой клинико–лабораторная ремиссия развилась у 15% больных, а через 12 месяцев лечения – более чем у 1/4 больных (табл. 5).
Рис. 3. Динамика индекса активности через 6 и 12 месяцев лечения Аравой (DAS4, DAS3, DAS28)
Кроме противовоспалительного эффекта, Арава обладает и влиянием на уровень РФ, уменьшает выраженность внесуставных проявлений РА и замедляет темпы прогрессирования деструктивных процессов в мелких суставах. До назначения Аравы титры РФі1:320 отмечались у 21 больного, через месяц терапии – у 13 больных, через 4 месяца – у 6 больных, а при длительности лечения 6 и более месяцев в нашей группе пациентов регистрировались только низкие титры РФ (8 больных) либо его отсутствие в сыворотке крови. Средний показатель логарифма титра сывороточного РФ снизился с 5,12 до 4,1–4,2 через 6 и 12 месяцев лечения (p Рис. 4. Увеличение числа эрозий и Кпр. за последовательные 6 мес.
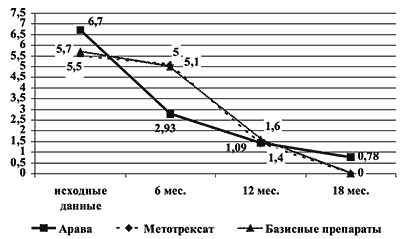
Рис. 5. Изменение числа эрозий на фоне лечения Аравой, метотрексатом и др. базисными препаратами
При индивидуальном анализе эффективности Аравы у больных РА мы получили ряд интересных данных. Наиболее медленно эффект Аравы появлялся у больных с давностью РА более 10 лет: за первые 6 месяцев степень уменьшения у многих больных большинства параметров активности варьировала от 20 до 30%, в отличие от больных с давностью болезни до 3–х лет, у которых степень улучшения этих же параметров составляла 60–75%. При продолжении лечения и у больных с большой длительностью РА эффективность Аравы нарастала (60–80%), но была все же несколько хуже, чем у больных с меньшей давностью болезни. Соответственно Арава была несколько менее эффективна у больных с IIIб–IV стадиями болезни (то есть при наличии остеолизов и анкилозов в мелких суставах кистей и стоп). Наиболее выраженный эффект в первое полугодие отмечался у больных с умеренной степенью активности (более 70% улучшения), а при высокой активности выраженность улучшения составляла 53%–64% от исходного уровня. К году терапии Аравой наибольший эффект отмечался при высокой степени активности РА. Арава была примерно в равной степени эффективна у больных с наличием или отсутствием РФ.
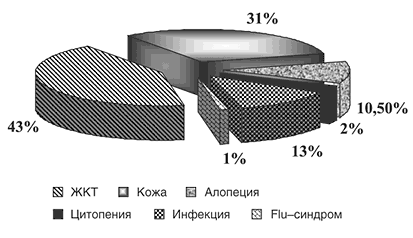
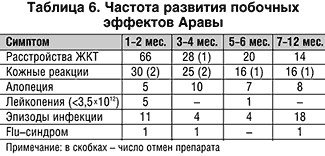
Рис. 6. Побочные эффекты Аравы
1. Арава эффективна у 94% больных.
1. Арава эффективна у 94% больных.
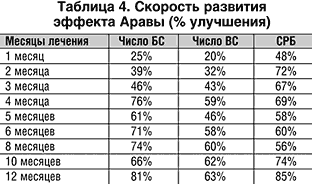
2. Отмечается быстрое развитие эффекта Аравы с достоверным снижением показателей суставного синдрома и лабораторных параметров активности воспаления через 1 месяц лечения, далее эффект лечения нарастает в течение 4–5 месяцев.
3. Наиболее быстро эффект Аравы развивается у больных с умеренной степенью активности, небольшой давностью РА (до 3–х лет), при отсутствии остеолизов и анкилозов в суставах.
4. Арава демонстрирует базисную активность, достоверно уменьшая титр РФ, внесуставные проявления РА (в том числе и проявления васкулита), достоверно замедляя темп рентгенологического прогрессирования, а у большинства больных с хорошим и отличным эффектом – останавливая деструктивный процесс.
5. Арава хорошо переносится больными, отмена препарата из–за симптомов непереносимости произведена в течение 1,5 лет у 10% больных.
6. На этапах лечения при развитии нежелательных реакций возможны временное снижение дозы препарата, перерывы в лечении, что не отражается на общей эффективности терапии.
1. David E.Yocum. «T–cells and therapeutic targets in rheumatoid arthritis (RA)». Sem. in Arthritis and Rheum., 1999;1:27–35.
2. F C Brredveld, J–M Dayer «Leflunomide: mode of action in the treatment of RA». Ann. Rheum. Dis., 2000;59:841–849.
3. Chervinski HM, Coln Rg, Cheung P, et al. «The immunosupressant Leflunomide inhibits lymphocyte proliferation by inhibiting pyrimidine biosynthesis». J Pharmacol. Exp. Ther. 1995;275:1043–9.
4. Siemasko KF, Chong ASF, Williams JW et.al. «Regulation of B cell function by the immunosuppressive agent leflunomide». Transplantation 1996;61:635–42.
5. Manna SK, Aggarwal BB. «Immunosuppressive leflunomide metabolite (A77 1726) blocks TNF–dependent nuclear factor–kb activation and dene expression». J. Immunol., 1999,162,2095–2102.
6. Hamilton L., Voinovic I., Bakhle Y., et al. The anti–inflammatory drug leflunomide inhibits in vitro and in vivo the activity of COX–2 more potently than the induction of COX–1 or iNOS». Br.J.Rheumatol., 1997,120,49
7. Kraan M.C., Reece R.G., Barg F.C., et al. «Expression of ICAM–1 and MMP–12 in rheumatoid synovial tissue after treatment with leflunomide or methotrexate». Ann.Scient. Meet. Amer. Coll. Rheumatol., 1999,Boston.
8. Cao W, Kao P, Aoki Y., et al. A novel mechanism of action of the immunomodulatory drug, leflunomide: augmentation of the immunosuppressive cytokine, TGF–bl, and suppression of the immunostimulatory cytokine, IL–2». Transplant. Proc., 1996, 28, 3079–3080.
9. M. Osiri, B. Shea, V. Robinson et.al.. «Leflunomide for the treatment of RA: a systematic review and methanalysis». J. of Rheum.,2003:30:6.
10. A. Prakash and B. Jarvis. «Leflunomide – a review of its use in active RA». Drugs 1999; 58:1137–1164.
12. Cohen S, Weaver A, Schiff M, Strand V. «Two–year treatment of active RA with leflunomide compared with placebo or methotrexate». Arthr. rheum. 1999; 42: Abstract.
13. Sciff MN, Strand V, Oed C, Loew–Fridirrich I. «Leflunomide: efficacy and safety in clinical trials for the treatment of RA». Drugs today. 2000;36:383–394.
14. American College of rheumatology, E. Matteson, J. J. Cush. «Reports of leflunomide hepatotoxicity in patients with RA». 2001.
15. Felson DT, Anderson JJ, Boers M, et al. «The American College of rheumatology preliminary core set of disease activity measures for RA clinical trials». Arthritis Rheum 1993; 36:729–40.
16. Van der Heijde D.M.F.M, van`t Hof M.A, van Riel P.L.C.M, et.al. «Validity of single variables and composite indices for measuring disease activity in RA». Ann Rheum Dis. 1992;51:177–181.
17. Smolen J.S, Breedveld F.C, Eberl G,et.al. «Validity and reliability of the twenty–eight–joint count for the assessment of RA activity». Arthr. Rheum. 1995;38:38–43.
18. Prevoo M.L.L, van`t Hof M.A, Kuper H.H et.al. «Modified disease activity scores that include twenty–eight–joint counts». Arthr. Rheum. 1995;38:44–48.
19. Van Gestel AM, Prevoo MLL, van’t Hof MA et.al. «Development and validation of the European League Against Rheumatism response criteria for RA». Arthr. Rheum. 1996; 39:34–40.
20. Крель А.А., Болотин Е.В., Каневская М.З., Ращупкина З.П., Чичасова Н.В. «Объективизация проявлений РА, характеризующих его эволюцию. I. Метод количественной оценки выраженности ревматоидного артрита и темпов его прогрессирования в суставах кистей и стоп». Вопр. ревматизма 1981;3:11–15.
21. Насонов Е.Л., Чичасова Н.В., Баранов А.А. и соавт. «Клиническое значение С–реактивного белка при РА (обзор литературы и собственные данные)». Клин.Мед.1997;6:34–36.
22. Van Leeuwen MA, van Rijswijk MH, Sluter WJ et al. «Individual relationship between progression of radiological damage and the acute phase response in early RA». J Rheumatol. 1997;24:20–7.
_575x.gif)
.gif)
.gif)
.gif)