mft тест что это
media fill test
Смотреть что такое «media fill test» в других словарях:
Media Research Center — Founder(s) L. Brent Bozell III Type media analysis Founded October 1, 1987 Location Alexandria, Virginia … Wikipedia
Media and Publishing — ▪ 2007 Introduction The Frankfurt Book Fair enjoyed a record number of exhibitors, and the distribution of free newspapers surged. TV broadcasters experimented with ways of engaging their audience via the Internet; mobile TV grew; magazine… … Universalium
Media Watch (TV program) — This article is about the Australian television program. For other uses, see Media Watch. Media Watch Directed by David Rector Presented by … Wikipedia
Filler (media) — In media, filler is material that is combined with material of greater relevance or quality to fill out a certain volume.Early TVIn the early days of television, most output was live. The hours of broadcast were limited and so, for test purposes … Wikipedia
Abbreviated Test Language for All Systems — (ATLAS) is a MILSPEC language for automatic testing of avionics equipment. It is a high level computer language and can be used on any computer whose supporting software can translate it into the appropriate low level instructions.HistoryThe… … Wikipedia
Validation (drug manufacture) — Within the highly regulated environment for development and manufacturing of Pharmaceutical Drugs and medical devices there is a requirement within the regulations to provide an appropriate amount of assurance that critical processes in producing … Wikipedia
Chevrolet Volt — Manufacturer Chevrolet division of General Motors Also called Holden Volt Opel Ampera Vauxhall Ampera … Wikipedia
education — /ej oo kay sheuhn/, n. 1. the act or process of imparting or acquiring general knowledge, developing the powers of reasoning and judgment, and generally of preparing oneself or others intellectually for mature life. 2. the act or process of… … Universalium
china — /chuy neuh/, n. 1. a translucent ceramic material, biscuit fired at a high temperature, its glaze fired at a low temperature. 2. any porcelain ware. 3. plates, cups, saucers, etc., collectively. 4. figurines made of porcelain or ceramic material … Universalium
China — /chuy neuh/, n. 1. People s Republic of, a country in E Asia. 1,221,591,778; 3,691,502 sq. mi. (9,560,990 sq. km). Cap.: Beijing. 2. Republic of. Also called Nationalist China. a republic consisting mainly of the island of Taiwan off the SE coast … Universalium
Military equipment of Turkey — The military equipment of Turkey includes a wide array of arms, artilleries, large surface vessels, cannons, armored vehicles, mortars, unmanned vehicles and many different equipments. Contents 1 Historical development 1.1 General 1.2 1923 1950 … Wikipedia
Данная страница не существует!
Услуги инфекционной клиники
Диагностика, профилактика и лечение
Фиброэластометрия и УЗ-диагностика молочных желез, щитовидной железы, мошонки, брюшной полости
Биохимия. Анализ крови: общий, клинический. Анализы на витамины, микроэлементы и электролиты. Анализ на ВИЧ-инфекцию, вирусные гепатиты, бактерии, грибки и паразиты
Максимально точное определение выраженности фиброза печени неинвазивным методом при помощи аппарата FibroScan 502 TOUCH
Гинеколог в H-Сlinic решает широчайший спектр задач в области женского здоровья. Это специалист, которому вы можете полностью доверять
Дерматовенерология в H-Сlinic — это самые современные и эффективные алгоритмы диагностики и лечения заболеваний, передающихся половым путем, грибковых и вирусных поражений, а также удаление доброкачественных невусов, бородавок, кондилом и папиллом
Возможности вакцинопрофилактики гораздо шире Национального календаря прививок. H-Clinic предлагает разработку плана вакцинации и современные высококачественные вакцины в наличии
Терапевт в H-Сlinic эффективно решает задачи по лечению заболеваний, которые зачастую могут становиться большой проблемой при наличии хронического инфекционного заболевания
Врач-кардиолог H-Сlinic проведет комплексную диагностику сердечно-сосудистой системы и при необходимости назначит эффективное терапию. Сердечно-сосудистые проблемы при инфекционных заболеваниях, требуют специфичных подходов, которые мы в состоянии обеспечить
Наша цель — новое качество вашей жизни. Мы используем современные диагностические алгоритмы и строго следуем наиболее эффективным протоколам лечения.
Общая терапия, Инфекционные заболевания, Гастроэнтерология, Дерматовенерология, Гинекология, Вакцинация, УЗИ и фиброэластометрия, Кардиология, Неврология
Биохимия, Общий/клинический анализ крови, Витамины и микроэлементы/электролиты крови, ВИЧ-инфекция, Вирусные гепатиты, Другие инфекции, бактерии, грибки и паразиты, Комплексы и пакеты анализов со скидкой
В наличии и под заказ качественные бюджетные решения и препараты лидеров рынка лечения инфекционных болезней. Аптека H-Clinic готова гибко реагировать на запросы наших клиентов. Мы поможем с оперативным поиском препаратов, которые обычно отсутствуют в сетях.
Медиафилтест
1. Возможно ли при проведении МФТ производить асептическую рассыпку инертного порошка во флаконы с последующим контролем стерильности с использованием системы Steritest?
2. Возможно ли при проведении МФТ производить асептическую рассыпку инертного порошка во флаконы в зоне А, а затем питательную среду добавлять в помещении ОКК путём прокола шприцом пробки под ламинаром?
Если есть возможность, ответы с сылками на разрешительную документацию.
А купить стерильную питательную среду финансовые возможности не позволяют?
Техотчет PDA 22
.
1. Внутри линейная фасовка порошка и следующая за ней вне линейная фасовка жидкости
Этот подход аналогичен вышеуказанному (внутри линейная фасовка порошка с последующей фасовкой жидкости в линии), за тем исключением, что жидкость добавляется в тару после ее удаления с фасовочной линии. Среда может быть добавлена в тару вручную в том же фасовочном помещении или в совершенно другой асептической зоне. При добавлении жидкой среды в тару содержащую порошок в асептической зоне отличной от фасовочной, тару необходимо опечатывать перед удалением из зоны фасовки порошка, и ее наружные поверхности должны быть санитизированы перед попаданием в другую асептическую зону. Затем пробки удаляют вручную, вводят жидкую среду, и тару переукупоривают. Рекомендуется использование изолирующей технологии для вне линейного добавления жидкости.
Преимущества
Отсутствуют; продолжительные нерутинные манипуляции добавляются к асептическому процессу фасовки.
Недостатки
Увеличение количества манипуляций с тарой.
Необходимость установки второй фасовочной (машины) и ее валидации.
.
2. Особые предосторожности характерные для имитации асептической фасовки стерильных порошков
Отрицательные контроли – За исключением подхода фасовки жидкой среды фасовочным оборудованием для порошка, все имитационные испытания для сухих порошков вовлекают фасовку как стерильной жидкости так и стерильного порошка. Принято наполнять какое-то количество тары только жидкостью для использования в качестве негативного контроля. Назначение такой процедуры фасовки жидкости – подтвердить, что система фасовки жидкости не является источником микробной контаминации, в случае если комбинированная фасовка покажет наличие таковой. Обычно единицы тары наполняют жидкостью перед началом фасовки порошка. Это обеспечивает отмену дальнейшей фасовки в случае несостоятельности процесса фасовки жидкости.
Отрицательные жидкостные контроли не являются требованием, но могут быть проведены производителем по его усмотрению. Это может быть использовано в случае если у производителя есть опыт успешной фасовки жидкостей с использованием того же оборудования. Отсутствие отрицательных контролей жидкостной фасовки может создать проблемы в определении причин непрохождения испытаний, но уменьшает количество заполняемых единиц, что является преимуществом.
При использовании отрицательных контролей, обнаружение микробной контаминации в любом из контролей, приводит к аннулированию результатов имитации.
Диаскинтест
Диаскинтест – кожная проба на определение наличия туберкулеза, характеристики развития патологического процесса. С помощью теста устанавливается активная форма заболевания всех органов, бессимптомное носительство, при котором больной является носителем микобактерий.
Среди преимуществ теста выделяют:
Почему нужно делать прививку ДСТ
Возбудитель заболевания – микобактерия туберкулеза. Развивается на фоне снижения иммунитета, недостаточном питании, частом переохлаждении, недоедании, инфицировании ВИЧ, наркомании, нервном переохлаждении. Передается несколькими путями:
В острой форме туберкулеза наблюдается длительный и влажный кашель с выделением мокроты; гипертермия. Больной резко теряет в весе, жалуется на утомляемость, общее ухудшение состояния здоровья. Теряется работоспособность.
Кашель влажный, ярко выраженный. Возникает в виде частых приступов, особенно в утреннее время. Часто заболевание на начальной стадии ошибочно путают с «кашлем курильщика», симптомами хронического бронхита.
Мнение эксперта
Врач пульмонолог, доктор медицинских наук, профессор, врач высшей квалификационной категории
Согласно статистике, носителями палочки Коха, возбудителя туберкулеза, являются 90 % населения. При этом заболеваемость регистрируется только у 5 %. Болезнь развивается на фоне иммунодефицита, поэтому важно вести здоровый образ жизни и заниматься профилактикой.
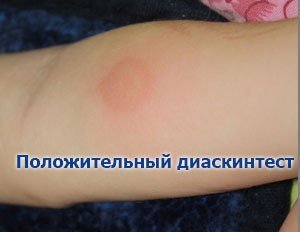
Диаскинтест позволяет выполнить диагностику туберкулеза. Метод отличается от классического Манту своей точностью. Результативность Диаскинтеста составляет 90 %. Для сравнения: точность Манту колеблется от 50 до 70 %. В Юсуповской больнице используют Диаскинтест для диагностики туберкулеза. Метод эффективен и с профилактической целью. Оценка результатов производится спустя 72 часа. Диаскинтест хорошо переносится, редко вызывает аллергические реакции. Даже при возникновении индивидуальной непереносимости на компонент теста, нежелательные реакции исчезают спустя 2–3 дня.
Диаскинтест зарекомендовал себя с положительной стороны у большинства отечественных врачей. Диагностика активно внедряется в лечебные учреждения. Высокая результативность позволяет назначать корректное лечение. Это важно, так как туберкулез характеризуется прогрессивным течением и высокой смертностью без адекватной терапии.
Принцип действия анализа
Применяется Диаскинтест для постановки внутрикожной пробы во всех возрастных группах с целью:
Проба через тест Диаскинтест проводится в следующих случаях:
Отличие от Манту?
Главное отличие Диаскинтеста от классического Манту в точности данных. При проведении Манту точность результата колеблется от 50 до 70%. Испытания показали, что внутрикожный тест имеет точность данных на 90%.
Кроме этого, каждый из тестов имеет разный состав, в которых входят отличные друг от друга действующие вещества. В Манту главный действующий элемент – туберкулин, содержащийся в туберкулезных бактериях. Однако данный белок присутствует не только в туберкулезе, но и микроорганизмах, схожими с болезнью. Диаскинтест содержит в качестве основного элемента белок, который имеется только в данном недуге. Поэтому реакция на проведения анализов разная. При положительной пробе на Манту имеется высокий риск наличия бактерий, которые не являются возбудителями туберкулеза.
При получении положительного результата после проведения Диаскинтеста, то можно быть полностью уверенным в заражении туберкулезом, а значит вовремя применить правильное лечение.
Таким образом, метод показывает более точные результаты в обнаружении опасного заболевания, применить лечение во избежание серьезных осложнений. практика обследований показывает, что Диаскинтест эффективен на любых, даже самых ранних стадиях туберкулеза
Показания и противопоказания теста
Применяется для проведения внутрикожной пробы лиц разной возрастной группы, а также для проведения оценки активности инфекционного процесса. С помощью теста удается определить лиц, относящихся к группе с высоким риском инфицирования, получения активной фазы.
Применяется для дифференциальной диагностики туберкулеза, а также в борьбе с инфекционной и поствакцинальной аллергии. Часто назначается врачами в подтверждении качества лечения.
Диаскинтест не вызывает реакции гиперчувствительности замедленного типа, которая часто проявляется при вакцинации БЦЖ.
Вместе с показанием существует ряд случаев, при которых не рекомендуется проводить тест на выявление туберкулеза. К ним относятся:
В детский учреждениях, где часто устанавливается карантин, проба проводится после его снятия. Иногда при применении возникает ряд побочных действий, что проявляется в виде недомогания, головной боли, повышения температуры тела. Запрещается применять вместе с профилактическими прививками. Проводится после их проведения, по окончанию 30 дневного срока.
Как делается DST
Прививка диаскинтест проводится только по назначению врача детям и взрослым только медицинским работником с допуском к осуществлению внутрикожных тестов.
Вводится Диаскинтест строго внутрикожно. Для проведения используются специальные туберкулиновые шприцы, тонкие короткие иглы. Перед применением препарата обязательно проверяется дата и срок годности. После вскрытия флакон с препаратом хранится не более двух часов.
Сколько делается Диаскинтест раз в год? Здоровым детям в возрасте от 8 до 18 лет назначается один раз в год во время массового обследования. При отсутствии прививки БЦЖ необходимо делать два раза в год. Взрослым в профилактических целях назначается раз в 12 месяцев.
При наличии сахарного диабета, заболеваний легких, язвенной болезнью желудка, легких и почек взрослым и детям проводится дважды в год с периодичностью в шесть месяцев. Разрешается ставить тест при положительной пробе Манту.
Во всех остальных случаях проведение назначается только по назначению врача. При этом действуют следующие правила:
Оценка результатов Диаскинтеста
После Диаскинтест оценка результатов пробы проводится медсестрой через 72 часа с момента введения вакцины. Во внимание берется измерение поперечного размера гиперемии и инфильтрата с помощью линейки в миллиметрах. Гиперемия берется во внимание только при отсутствии инфильтрата.
Ответная реакция на пробу воспринимается в следующих случаях:
Выявленная положительная реакция различается по степени проявления:
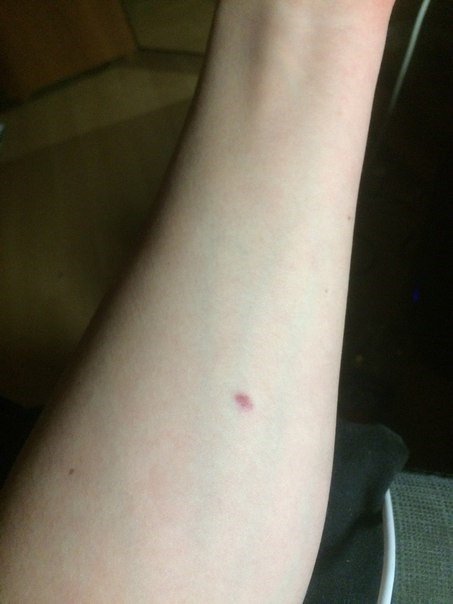
При отрицательном результате практически отсутствие отечности. Может быть заметен след от введения инъекции, гематома. Наличие синяка затрудняет проведение оценки, так как практически не видно покраснения. В спорных случаях назначается повторное проведение теста спустя два месяца.
В случае обнаружения положительной Диаскинтест интерпретации назначается обследование на наличие туберкулеза. Сопровождается сильной воспалительной реакцией. Аллергия и прочие реакции на введение препарата наблюдаются сразу и исчезают спустя 48-72 часа.
Диаскинтест интерпретация результатов может быть отрицательной у больного туберкулезом по причине иммунопатологических нарушений в организме, вызванных туберкулезными нарушениями организма. Также на ранних стадиях туберкулезного процесса, при наличии сопутствующих болезней, сопровождающихся иммунодефицитным состоянием.
Причины сомнительной и гиперергической реакции на тест
Ответная реакция на проведение теста может быть положительной гиперергической и сомнительной. Такое процессы указывают на отсутствие заболевания и его возбудителей в организме. Объяснение этому следующее:
Такой реакции на проведение теста могут служить и иные причины. Людям, предрасположенным к аллергии часто перед проведением пробы, вводятся антигистаминные препараты.
Чтобы не возникло ложноположительной реакции необходимо строго придерживаться мер по противопоказаниям. Взрослым запрещается употребление алкоголя до и после введения Диаскинтеста. Продукты распада этилового спирта с реакцией препарата могут вызвать покраснение места укола, что будет воспринято за Диаскинтест реакция как положительная.
Не рекомендуется мочить место проведения пробы, помещать общественные бани, сауны, пляж или бассейн. Такие меры могут вызвать ответную реакцию.
Фото результатов
Можно самостоятельно определить результат теста, не дожидаясь осмотра у медсестры по фото с итогом проведения.
Диаскинтест фото проведенного у ребенка имеет положительный результат. Размер инфильтрата составляет более 5 мм.
При сравнительном результате наблюдается размер инфильтрата 2-4 мм.
Предложенное фото указывает на отрицательный результат. При нем может оставаться след от введения, инфильтрат полностью отсутствует.
Отзывы об анализе
С момента активного применения Диаскинтест отзывы заслужил положительные среди врачей по всему СНГ. Препарат позволяет получить правильный результат в 90% случаях. С его помощью удается определить наличие туберкулезной инфекции, качество лечения и т.д. С его помощью легко определить заболевание у взрослых и детей.
Диаскинтест отзывы отрицательные получает редко. Причина их появления в побочных реакциях организма на введенную инъекцию.
DST тест в Юсуповской больнице
Где можно сделать Диаскинтест? Данный тест проводится в государственных и частных туберкулезных диспансерах. Проводится строго один-два раза в год в соответствии с назначением врача. Детям вводится в детских садах и школах в соответствии с планом вакцинации.
В среднем по Москве Диаскинтест стоимость составляет 1400 рублей. проводится после посещения фтизиатра, педиатра.
Где сделать в Москве? Данная услуга доступна в клинике «Юсуповская больница». Проводится профессионалами. Клиентам предоставляется возможность пройти предварительную консультацию, а также при получении положительного результата пройти курс терапии с дополнительными методиками для скорого выздоровления. Диаскинтест сделать можно по недорогой цене.
Статьи Экспертов
Отправить жалобу
Только авторизованные пользователи могут оставлять жалобы
Анализ несоответствий, выявляемых при инспектировании на соответствие требованиям GMP (часть 1, Media fill)
При инспектировании производителей лекарственных средств на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP) выявляются различные несоответствия. Некоторые из них являются типичными и встречаются довольно часто. В предыдущей статье уже были перечислены несколько типичных несоответствий, данные о которых были представлены ФГБУ «ВГНКИ» в разное время. В продолжение этой темы мы подробно рассмотрим несколько нарушений, приведенных на сайте уполномоченного учреждения в сентябре 2018 года и связанных с моделированием процесса с использованием питательной среды (Media fill).
При рассмотрении данной темы мы воспользуемся следующими документами и материалами:
— Приложение 1 к Правилам GMP (Правила GMP, действующие в России; Правила GMP ЕАЭС; Правила GMP ЕС, включая планируемые в них изменения);
— Технический отчет PDA* №22 «Process Simulation for Aseptically Filled Products» («Моделирование процесса для асептически наполняемой продукции»);
— PI 007-6**«Recommendation on the Validation of Aseptic Processes» («Рекомендации по валидации асептических процессов»);
— ГОСТ Р ИСО 13408-1-2000 «Асептическое производство медицинской продукции. Часть 1. Общие требования»;
— материалы семинаров и статей, опубликованных в России (FAVEA, ФБУ «ГИЛС и НП» и др.).
В таблице ниже представлено сравнение текста, описывающего требования к моделированию процесса с использованием питательной среды в Приложении 1 к Правилам GMP (соответствующие разделы: «Технологический процесс», «Processing» и «Aseptic process simulation (APS)»). Чтобы избежать возможных проблем, связанных с переводом, выдержки из текста Правил GMP ЕС приведены в таблице только на английском языке.
Требования Правил GMP
Типичные
Приложение 1 к Правилам GMP, утвержденным Приказом Минпромторга России от 14 июня 2013 года № 916 (действующие)
Приложение 1 к Правилам GMP ЕАЭС, утвержденным Решением Совета ЕЭК от 3 ноября 2016 года № 77 (вступают в действие с 01.01.2021 года)
Приложение 1 к Правилам GMP Европейского Союза EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Volume 4) (действующие)
Проект актуализированного Приложения 1 к Правилам GMP Европейского Союза
(EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Volume 4)
1. Валидация процессов, проводимых в асептических условиях, не включает моделирование процесса с использованием питательной среды (наполнение питательными средами).
73. (66) Валидация процессов, проводимых в асептических условиях, должна включать моделирование процесса с использованием питательной среды (наполнение питательными средами).
66. Валидация процессов, проводимых в асептических условиях, должна включать моделирование процесса с использованием питательной среды (наполнение питательными средами).
66. Validation of aseptic processing should include a process simulation test using a nutrient medium (media fill).
9.34 Periodic verification of the effectiveness of the controls in place for aseptic processing should include a process simulation test using a sterile nutrient media and/or placebo.
2. Моделирование процесса не точно имитирует серийный процесс асептического производства и не включает в себя его последовательные критические стадии. Не учтены различные вмешательства, которые могут возникнуть во время обычного производственного процесса, а также ситуации «наихудшего случая».
74. (67) Моделирование процесса должно наиболее точно имитировать серийный процесс асептического производства и включать в себя его последовательные критические стадии. Также необходимо учитывать различные вмешательства, которые могут возникнуть во время обычного производственного процесса, а также ситуации «наихудшего случая».
67. Моделирование процесса должно наиболее точно имитировать серийный процесс асептического производства и включать в себя его последовательные критические стадии. Также следует учитывать различные вмешательства, которые могут возникнуть во время обычного производственного процесса, а также ситуации «наихудшего случая».
67. The process simulation test should imitate as closely as possible the routine aseptic manufacturing process and include all the critical subsequent manufacturing steps. It should also take into account various interventions known to occur during normal production as well as worst-case situations.
9.35 The process simulation test should imitate as closely as possible the routine aseptic manufacturing process and include all the critical manufacturing steps. Specifically: …
9.36 The process simulation testing should take into account various aseptic manipulations
and interventions known to occur during normal production as well as worst-case situations, including: …
9.37 There should be an approved list of allowed interventions, …
3. Не соблюдается периодичность проведения моделирования процесса с использованием питательной среды. Не соблюдается периодичность участия операторов в моделировании процесса с использованием питательной среды.
75. (68) Моделирование процесса при первоначальной валидации должно включать три последовательных удовлетворительных испытания для каждой смены операторов. В дальнейшем их необходимо повторять через установленные промежутки времени, а также после любого существенного изменения в системе вентиляции и кондиционирования воздуха, в оборудовании, процессе или количестве смен. Моделирующие процесс испытания должны повторяться дважды в год для каждой смены операторов и каждого процесса.
68. Моделирование процесса при первоначальной валидации должно включать три последовательных удовлетворительных испытания для каждой смены операторов. В дальнейшем их следует повторять через установленные промежутки времени, а также после любого существенного изменения в системе вентиляции и кондиционирования воздуха, в оборудовании, процессе или количестве смен. Как правило, моделирующие процесс испытания следует повторять дважды в год для каждой смены операторов и каждого процесса.
68. Process simulation tests should be performed as initial validation with three consecutive satisfactory simulation tests per shift and repeated at defined intervals and after any significant modification to the HVAC-system, equipment, process and number of shifts. Normally process simulation tests should be repeated twice a year per shift and process.
9.40 Process simulation tests should be performed as initial validation, generally with three consecutive satisfactory simulation tests per shift, and after any significant modification to the HVAC system, equipment, major facility shut down, process and number of shifts, etc. Consideration should be given to performing an APS after the last batch prior to shut down, before long periods of inactivity or before decommissioning or relocation of a line. Normally process simulation tests (periodic revalidation) should be repeated twice a year (approximately every six months) for each aseptic process and filling line, and at least annually for each operator.
МОДЕЛИРОВАНИЕ ПРОЦЕССА С ИСПОЛЬЗОВАНИЕМ ПИТАТЕЛЬНОЙ СРЕДЫ
Валидация процессов, проводимых в асептических условиях, должна включать моделирование процесса с использованием питательной среды (наполнение питательными средами)
— моделирование процесса необходимо для подтверждения того, что регулярное производство повторяемо и надежно предоставляет готовую продукцию необходимого качества;
— наполнение питательными средами необходимо для подтверждения того, что регулярное наполнение повторяемо и надежно предоставляет готовую продукцию необходимого качества;
— обучение персонала (операторов производства и технического персонала, подразделений контроля и обеспечения качества) порядку переодевания, поведения в чистых производственных помещениях.
В п. 9.34 проекта актуализированного Приложения 1 к Правилам GMP ЕС также указано, что моделирование процесса может быть проведено с использованием питательной среды и/или плацебо («… and/or placebo»).
Необходимо понимать, что наполнение средами в сочетании с надлежащим контролем окружающей среды может быть исключительно ценным для доказательства того, что асептическое приготовление стерильных растворов, суспензий и порошков выполняется требуемым образом.
Моделирование процесса должно наиболее точно имитировать серийный процесс асептического производства и включать в себя его последовательные критические стадии. Также необходимо учитывать различные вмешательства, которые могут возникнуть во время обычного производственного процесса, а также ситуации «наихудшего случая»
Согласно п. 5.1.1 рекомендаций PIC/S PI 007-6: Все оборудование должно остаться таким же, как при рутинном процессе. Необходимо использовать соответствующие комбинации для размера емкостей, размера отверстий и скорости производственной линии (минимальные/максимальные) («All equipment should remain the same wherever practicable as for the routine process. Appropriate combinations of container size and opening as well as speed of the processing line should be used (preferably at the extremes)»).
В п. 9.35 проекта актуализированного Приложения 1 к Правилам GMP ЕС уже приведены следующие частные случаи:
a) Моделирование процесса должно оценивать все асептические операции, выполняемые после стерилизации материалов, используемых в процессе («Process simulation tests should assess all aseptic operations performed subsequent to the sterilisation of materials utilised in the process»);
b) Для нефильтруeмой продукции следует оценить любые дополнительные асептические стадии («For non-filterable formulations any additional aseptic steps should be assessed»);
c) Асептическое производство, выполняемое в строго анаэробной среде, должно оцениваться с использованием анаэробных сред в дополнение к аэробной оценке («Aseptic manufacturing performed in a strict anaerobic environment should be evaluated with an anaerobic media in addition to aerobic evaluation»);
d) Процессы, требующие добавления стерильных порошков, должны использовать приемлемый суррогатный материал в контейнерах, идентичных тем, которые используются в оцениваемом процессе («Processes requiring the addition of sterile powders should employ an acceptable surrogate material in containers identical to those utilised in the process being evaluated»);
e) Процессы, связанные со смешиванием, измельчением и разделением стерильного порошка, требуют такого же внимания («Processes involving blending, milling and subdivision of a sterile powder require similar attention»);
f) Моделирование процесса для лиофилизированных продуктов должно включать всю цепочку асептической обработки, включая наполнение, транспортировку, загрузку, выдержку в камере, выгрузку и герметизацию. Моделирование процесса должно дублировать процесс лиофилизации, за исключением замораживания и сублимации, включая частичный вакуум и продолжительность цикла, и параметры, подходящие для среды. Следует избегать кипячения или фактического замораживания раствора («The process simulation test for lyophilized products should include the entire aseptic processing chain, including filling, transport, loading, chamber dwell, unloading and sealing. The process simulation should duplicate the lyophilization process, with the exception of freezing and sublimation, including partial vacuum and cycle duration and parameters as appropriate for the media. Boiling over or actual freezing of the solution should be avoided»).
В п. 9.36 проекта актуализированного Приложения 1 к Правилам GMP ЕС уже указано, какие вмешательства должны быть включены:
а) Непосредственные вмешательства при максимально допустимой частоте на количество заполненных единиц («Inherent interventions at the maximum accepted frequency per number of filled units»);
b) Корректирующие вмешательства в репрезентативном количестве и с наивысшей приемлемой степенью проведения («Corrective interventions in representative number and with the highest degree of intrusion acceptable»).
Согласно техническому отчету PDA №22:
— непосредственные вмешательства составляют неотъемлемую часть процесса («integral part of the process»);
— корректирующие вмешательства выполняются для устранения проблем («performed to fix problems»).
При этом вмешательства должны быть в центре внимания, поскольку загрязнение в значительной степени связано с ними («Interventions must be the focus of the discussion because contamination is largely associated with them»).
Примеры
— непосредственные вмешательства, требующиеся для настройки, рутинной работы и/или мониторинга: для асептической сборки, пополнения контейнеров, отбора проб окружающей среды и т. д. («… required for either set-up, routine operation and/or monitoring, e.g., aseptic assembly, container replenishment, environmental sampling, etc.»);
— корректирующие вмешательства, требующиеся для корректировки или настройки асептического процесса во время его выполнения: для устранения застреваний компонентов, остановки протечек, регулировки датчиков и замены компонентов оборудования («… performed to correct or adjust an aseptic process during its execution… Examples include such activities as: clearing component jams, stopping leaks, adjusting sensors, and replacing equipment components»).
Согласно п. 7.4.1 рекомендаций PIC/S PI 007-6: Очень важно включать в моделирование процесса различные вмешательства, которые, как известно, происходят во время обычных производственных циклов, например, ремонт или замена дозирующих устройств/трубок; замена фильтров; микробиологический отбор проб силами персонала, проводящего мониторинг, и с помощью пробоотборников; продолжительность остановок на линии, наполнение и операции с пробками и т. д. («It is essential to include in a simulation test the various interventions that are known to occur during normal production runs, e.g. repair or replacement of needles/tubes, replacement of on-line filters, microbial sampling by monitoring personnel and sampling device, duration of stops on the line, filling and handling of stoppers etc.»).
Еще несколько практических примеров непосредственных вмешательств: силиконизация вращающегося стола для контейнеров; проверка веса наполнения; проверка фильтра на целостность методом «точки пузырька»; добавление компонентов (контейнеры, пробки, крышки); перерыв для отдыха и питания; любое другое вмешательство, которое является частью обычного процесса.
Еще несколько практических примеров корректирующих вмешательств: удаление с линии контейнера, застрявшего на машине; удаление с линии упавшего флакона; плохо прилегающие пробки, требующие ручных манипуляций; любая другая проблема, требующая ручной коррекции.
Согласно п. 17.5.2 ГОСТ Р ИСО 13408-1-2000: Следует иметь перечень допустимых и предписанных вмешательств во время проведения асептического процесса.
В п. 9.37 проекта актуализированного Приложения 1 к Правилам GMP ЕС уже также приводятся требования к перечню этих вмешательств: Должен быть утвержденный список допустимых вмешательств, как непосредственных, так и корректирующих, которые могут возникать во время производства и при APS. Процедуры, в которых перечислены виды непосредственных и корректирующих вмешательств и способы их проведения, должны быть, при необходимости, обновлены для обеспечения согласованности с фактической производственной деятельностью («There should be an approved list of allowed interventions, both inherent and corrective, which may occur during production and in the APS. The procedures listing the types of inherent and corrective interventions, and how to perform them, should be updated, as necessary, to ensure consistency with the actual manufacturing activities»).
Согласно п. 17.5.3 ГОСТ Р ИСО 13408-1-2000: Наполнение средами должно проводиться в производственных условиях, включая условия «наихудшего случая», например, при наибольшем практически возможном числе допустимых вмешательств, устранении остановок линии, ремонте или замене игл или трубок, замене установленных в линии фильтров, изменении численности привлекаемого персонала и пр.
Согласно примечанию к п. 17.5.4 ГОСТ Р ИСО 13408-1-2000: Если асептическому наполнению подлежит множество упаковок одной формы, но различных размеров, то можно отобрать определенные размеры для наполнения средами. Контейнеры с наиболее широким отверстием и наименьшая скорость движения линии должны быть включены в режим наполнения средами и могут представлять условия наихудшего случая. Однако в некоторых случаях маленькие упаковки представляют условия наихудшего случая из-за недостаточной стабильности контейнеров при работе линии и необходимости более частого ручного вмешательства.
Следует помнить, что валидация проводится не только для стадии асептического наполнения, а также для стадии приготовления/ смешения и лиофилизации, при ее наличии.
Моделирование процесса при первоначальной валидации должно включать три последовательных удовлетворительных испытания для каждой смены операторов. В дальнейшем их следует повторять через установленные промежутки времени, а также после любого существенного изменения в системе вентиляции и кондиционирования воздуха, в оборудовании, процессе или количестве смен. Моделирующие процесс испытания должны повторяться дважды в год для каждой смены операторов и каждого процесса.
Следует различать первоначальную валидацию, повторную внеплановую валидацию и повторную плановую валидацию. Периодичность валидации отличается для нового асептического процесса, существующего асептического процесса с изменениями и существующего асептического процесса без изменений.
Согласно п. 17.4.2 ГОСТ Р ИСО 13408-1-2000: Следует повторить аттестацию в эксплуатации асептического процесса или линии наполнения, если:
a) превышен уровень действия (если только не установлено, что он из-за вызванной внешними обстоятельствами причины);
b) производственная линия не эксплуатировалась в течение длительного периода времени, например, одного года;
c) произошли существенные изменения.
В п. 9.40 проекта актуализированного Приложения 1 к Правилам GMP ЕС также указано, что APS необходимо повторять в случае прекращения работы объекта («…facility shut down, …»). При этом следует рассмотреть возможность выполнения моделирования асептического процесса после последней партии до прекращения работы, до длительных периодов простоя или до вывода из эксплуатации или перемещения линии («Consideration should be given to performing an APS after the last batch prior to shut down, before long periods of inactivity or before decommissioning or relocation of a line»).
Здесь же конкретизировано, что:
— под периодичностью «дважды в год» подразумевается «примерно каждые шесть месяцев» («approximately every six months»);
— под «каждым процессом» понимается «для каждого асептического процесса и линии наполнения» («for each aseptic process and filling line»).
Согласно примечанию к п. 17.4.2 ГОСТ Р ИСО 13408-1-2000: Инструкции по контролю изменений должны определять существенные изменения, такие как:
— изменения в оборудовании, непосредственно контактирующем с нерасфасованным продуктом или продуктом/контейнером;
— изменения в оборудовании или помещениях, которые могут оказать влияние на качество воздуха или воздушные потоки;
— существенные изменения в производственном персонале, например, создание новых бригад;
— образование дополнительных производственных смен.
Среди опубликованных в апреле 2018 года на сайте Россельхознадзора ответов на некоторые часто задаваемые вопросы, приведен следующий комментарий к вопросу о том, должно ли проводиться моделирование процесса с использованием питательной среды на каждом заявленном объеме в процессе производства: «Предложение представителей Бизнес-сообщества о проведении наполнения питательными средами, в случае если на одном участке розлива предусмотрена первичная упаковка стерильных лекарственных средств разного объема, только на самых маленьких и (или) самых больших объемах, используя методологию анализа рисков, идет в разрез с действующим законодательством».
Если говорить о методологии анализа рисков, которая теоретически может быть использована при разработке плана моделирования процесса, то в п. 9.38 проекта актуализированного Приложения 1 к Правилам GMP ЕС, среди рассматриваемых принципов управления рисками, приведено следующее: Определение репрезентативных размеров контейнеров/комбинаций закрытия, которые должны использоваться для валидации. Брэкетинг и построение матриц могут быть рассмотрены для первоначальной валидации того же самого контейнера/конфигурации закрытия («Determining the representative sizes of container/closure combinations to be used for validation. Bracketing or a matrix approach can be considered for initial validation of the same container/closure configuration»).
Важно, что наполнение средами должно имитировать асептический процесс настолько, насколько это целесообразно из практических соображений.
В заключение хотелось бы заметить, что производителям ЛС при подготовке к инспектированию следует учитывать все возможные замечания со всех сторон и предоставлять все документальные подтверждения использованного подхода для валидации асептического процесса.
Особенно учитывая, что при классификации подобных несоответствий по степени критичности зачастую им присваивается существенный или критический уровень.
Например, в статье заместителя руководителя образовательного центра по надлежащим практикам ФБУ «ГИЛС И НП» Владимира Орлова***, в качестве одного из наиболее значимых выявленных отклонений при валидации асептического наполнения приведена недостоверность оценки полученных результатов, в том числе на этапе инкубации образцов (неоднократно были зафиксированы случаи документально не подтвержденной потери образцов при учете по завершении инкубации, при этом такие случаи не подлежали необходимому расследованию и оценке). Соответственно, у инспекторов возникали обоснованные сомнения в достоверности полученных результатов валидации данного процесса, что в случае асептического производства лекарственных средств является необходимым условием обеспечения стерильности продукции.
Наполнение средами является этапом в процессе проверки характеристик системы асептического производства, включая окружающую среду, оборудование и персонал. Оно не дает автоматической гарантии того, что продукция, изготовленная на той же линии в другие периоды времени, будет иметь тот же уровень микробиологического качества. Однако путем контроля и валидации таких сопутствующих процессов, как мониторинг окружающей среды, аттестация персонала, очистка и стерилизация, можно поддерживать уровень качества продукции, продемонстрированный с помощью наполнения средами.
_____________________________________________________________
***В.А. Орлов. Анализ ключевых тенденций по результатам инспектирования зарубежных производителей лекарственных средств за 2016 год // Разработка и регистрация лекарственных средств. 2017. V. 2(19).