какой метод окраски используется для выявления спор
Основа, методы и способы окрашивания спор
окрашивание спор методология, используемая для окрашивания структур устойчивости, которые образуют некоторые бактериальные роды, когда они находятся в неблагоприятных условиях; эти структуры соответствуют способу выживания.
Есть много родов, которые образуют споры; Однако основными из них являются Bacillus и Clostridium. Эти роды считаются более актуальными, потому что они имеют патогенные виды для людей.
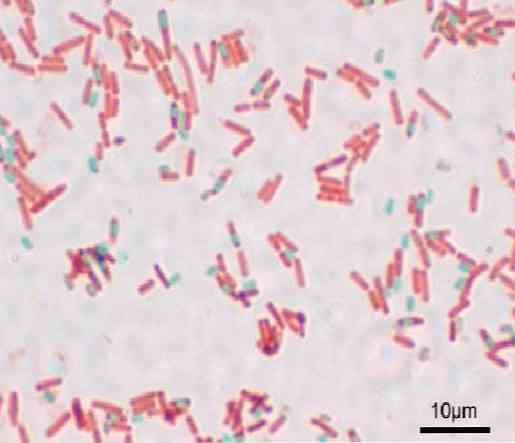
Каждая бацилла может породить спору. Во время окрашивания препарата спора может быть найдена внутри бациллы (эндоспора) или снаружи (экзоспора). При использовании традиционных методов окрашивания бактерий, таких как окрашивание по Граму, споры остаются бесцветными..
В настоящее время существует несколько методик окраски, которые способны пересекать толстую структуру споры и окрашивать ее. Эти методологии очень разнообразны; среди них можно упомянуть технику Дорнера, мельеровскую окраску и методологию Шеффера-Фултона, также известную как Вирц-Конклин..
Из всех упомянутых методик методология Шеффера-Фултона является наиболее используемой в рутинных лабораториях. Он обязан своим именем двум микробиологам, создавшим окраску в 1930 году: Алисии Шеффер и Макдональду Фултону. Однако иногда эту технику называют Вирц-Конклин в честь двух бактериологов 1900-х годов..
фундамент
Споры не окрашиваются обычными окрасками, потому что имеют очень толстую стенку. Сложный состав спор предотвращает проникновение большинства красителей.
Если споры изучаются снаружи внутрь, наблюдаются следующие слои: во-первых, экзоспорий, который является самым тонким наружным слоем, образованным гликопротеинами..
Затем следует кутикула, которая обеспечивает устойчивость к высоким температурам, за которой следует кора, состоящая из пептидогликана. Тогда есть стена основания, которая защищает протопласт.
Спора представляет собой обезвоженную структуру, которая содержит 15% кальция и дипиколиновой кислоты. Поэтому большинство методов окрашивания спор основаны на применении тепла, чтобы краситель мог проникать в толстую структуру..
Как только спора окрашена, она не может устранить краситель. В методике Шеффера-Фултона малахитовый зеленый проникает в вегетативные клетки и при воздействии тепла проникает в эндоспоры, а также в экзоспоры..
При промывании водой краситель удаляется из вегетативной клетки. Это происходит потому, что зеленый малахитовый краситель является слегка основным, поэтому он слабо связывается с вегетативной клеткой.
С другой стороны, он не может выйти из споры, и, наконец, контрастирует бацилла с сафранином. Эта основа действительна для остальных техник, в которых происходит нечто подобное.
Техника окраски спор
Чтобы споры окрасились, у вас должна быть чистая культура подозреваемого штамма, которую вы хотите изучить.
Культура подвергается воздействию экстремальных температур в течение 24 часов, чтобы стимулировать микроорганизм к споруляции. Для этого культуру можно поместить в духовку при 44 ° С или в холодильник (8 ° С) на 24 или 48 часов..
Если при указанных температурах останется слишком много времени, будут наблюдаться только экзоспоры, поскольку все эндоспоры покинут бациллу..
В конце времени, несколько капель стерильного физиологического раствора должны быть помещены на чистое предметное стекло. Затем берется небольшая часть урожая и производится мелкий спред.
После этого его оставляют сохнуть, его фиксируют на высокой температуре и окрашивают некоторыми методами, которые описаны ниже:
Техника Дорнера
1- Приготовьте в пробирке концентрированную суспензию спорулированного микроорганизма в дистиллированной воде и добавьте равный объем отфильтрованного Kinyoun фенольного фуксина.
2- Поместите пробирку в ванну с кипящей водой на 5-10 минут..
3- На чистом предметном стекле смешайте каплю предыдущей суспензии с каплей 10% водного раствора нигрозина, вскипятите и отфильтруйте.
4- быстро растягивается и сохнет при умеренном нагревании.
5- Исследуйте с 100X объективом (погружение).
Споры окрашиваются в красный цвет, а бактериальные клетки выглядят почти бесцветными на темно-сером фоне.
Модифицированная техника Дорнера
1- Суспензия спорулированного микроорганизма распределяется на предметном стекле и фиксируется на высокой температуре..
2- Образец покрывается полоской фильтровальной бумаги, к которой добавляется фуксин фениновой кислоты. Краситель нагревают в течение 5-7 минут с помощью пламени горелки Бунзена до тех пор, пока не образуются выделения паров. Затем бумага удаляется.
3- Вымойте препарат водой, а затем высушите с помощью впитывающей бумаги..
4- Покройте мазок тонкой пленкой из 10% нигрозина, используя второе предметное стекло, чтобы распределить нигрозин или иглу.
Окраска, полученная спорами и бактериями, такая же, как описанная в предшествующем уровне техники..
Техника Шеффера-Фултона или Вирца-Конклина
1- Сделайте тонкий спред с суспензией спорулированного микроорганизма на предметном стекле и закрепите его для нагревания..
2- Накройте предметное стекло водным раствором 5% малахитового зеленого (на листе можно разместить фильтровальную бумагу).
3. Нагрейте пламя горелки Бунзена, чтобы пар вышел и удалял пламя. Повторите операцию от 6 до 10 минут. Если во время процедуры малахитовый зеленый раствор испаряется слишком много, можно добавить еще.
4- Удалите фильтровальную бумагу (если она была размещена) и промойте водой.
5- Накройте предметное стекло 0,5% водным сафранином в течение 30 секунд (в некоторых вариантах техники используется 0,1% водный сафранин и оставьте его на 3 минуты).
С этой техникой споры зеленые и бациллы красные.
Недостатком является то, что эндоспоры молодых культур плохо окрашиваются, так как выглядят очень прозрачными или бесцветными. Чтобы избежать этого, рекомендуется использовать культуры 48 часов инкубации.
Техника Мёллера
1- Покройте мазок хлороформом в течение 2 минут..
2- Откажитесь от хлороформа.
4- промыть дистиллированной водой
5- Лист покрыт фуксин-фенольным карпом и подвергается воздействию пламени горелки Бунзена до момента выделения паров; затем он удаляется из пламени на несколько мгновений. Операция повторяется до 10 минут.
7- Используйте подкисленный этанол (соляной спирт) для обесцвечивания. Осталось на 20 или 30 секунд.
8- Промыть дистиллированной водой.
9- Противодействовать покрытию листа метиленовым синим в течение 5 минут..
10- Промыть дистиллированной водой.
Споры выглядят красными и синими бациллами. Важно не вдыхать пары, потому что они токсичны и в долгосрочной перспективе могут быть канцерогенными.
Модифицированная техника Мёллера без тепла
В 2007 году Хаяма и его сотрудники создали модификацию метода Мёллера. Они удалили этап нагревания красителя и заменили его добавлением 2 капель поверхностно-активного вещества Tergitol 7 на каждые 10 мл фуксин-фенольного карболического раствора. Те же результаты были получены.
приложений
Окраска спор предоставляет очень ценную и полезную информацию для идентификации возбудителя, так как наличие его, его форма, расположение в бацилле и способность деформировать вегетативную клетку или нет, являются данными, которые могут направлять вид участвует в определенном поле.
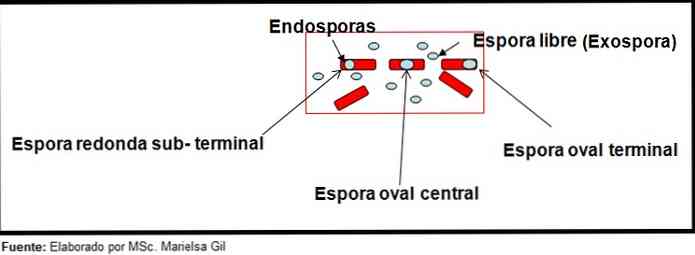
В этом контексте стоит упомянуть, что споры могут быть круглыми или овальными, они могут располагаться в центре или также в парацентральном, субтерминальном или терминальном положении.
примеров
— Clostridium difficile образует овальную спору в терминальном положении, которая деформирует бациллу.
— Спора Clostridium Tertium Он овальный, не деформирует бациллу и расположен на уровне терминала.
— Эндоспора Clostridium тетэни он терминальный и деформирует палочку, придавая вид голени.
— Споры Clostridium botulinum, С. histolyticum, С. Новый и C. septicum они округлые или субтерминальные овальные и деформируют бациллу.
— Эндоспора Clostridium sordelli он расположен в центральном положении, с небольшой деформацией.
Какой метод окраски используется для выявления спор
Жгутики бактерий очень тонки и легко отрываются. Поэтому обнаружить их можно только при специальной окраске или с помощью электронного микроскопа.
Выявить жгутики у бактерий, применив обычные способы окраски анилиновыми красителями невозможно.
Жгутики, как правило, становятся видимы, если препарат предварительно обработать протравой, а потом окрасить. Протравленный препарат легче воспринимает окраску, но самое главное то, что жгутики при осаждении на них протравы увеличиваются и становятся видимыми при микроскопировании.
Существуют разные способы окраски жгутиков, но в каждом отдельном случае в зависимости от индивидуальных свойств микробов приходится выбирать тот или иной способ.
Для успешной окраски жгутиков должны соблюдаться следующие условия:
1. Чистота предметных и покровных стекол должна быть идеальной.
2. Препарат должен готовиться из свежей агаровой суспензии культуры не старше суточной, а для некоторых видов (вибрион, сенная палочка) не старше 12 часов. Часть материала, взятую из посевной черты (ближе к конденсационной воде), где больше влаги переносят в пробирку с 1 – 2 мл стерильной водопроводной воды. Пробирки выдерживают 30 60 минут при комнатной температуре, затем взвесь бактерий переносится в каплю стерильной водопроводной воды или физиологического раствора, нанесенную на покровное стекло. При распределении материала на покровном стеклышке, надо соблюдать осторожность, чтобы механически не повредить жгутики инее оторвать их от тела бактерий.
Мазок должен быть тонким, чтобы особи могли расположиться изолировано друг от друга.
Воду на стекле следует распределять тонким слоем, чтобы ускорить высыхание препарата и уменьшить потерю жгутиков.
Наиболее часто для окрашивания жгутиков используют способ Леффлера (Loffler). Методика окраски:
1. На высушенный и зафиксированный мазок наливают протраву в таком количестве, чтобы покрыть всю поверхность покровного стеклышка, и выдерживают 3 – 5 минут при комнатной температуре.
2. По истечении указанного времени препарат осторожно и тщательно промывают проточной водой.
3. На препарат наносят раствор фуксина (1 часть насыщенного спиртового раствора фуксина на 10 частей воды) и препарат прогревают над пламенем до появления пара.
4. Препарат промывают водой и микроскопируют.
Приготовление протравы для выявления жгутиков бактерий:
12г танина растворяют при нагревании в 48 мл воды и к этому раствору прибавляют 30 мл насыщенного раствора фуксина в 95% этиловом спирте. Раствор отфильтровывают и хранят в стеклянной емкости с притертой пробкой. Протрава готова к употреблению через несколько дней после приготовления и может сохраняться в течение нескольких месяцев.
Для обнаружения жгутиков у простейших препараты можно окрашивать простым способом, используя метиловый синий, раствор Люголя или сложным методом по Романовскому – Гимза.
Выявление капсул у бактерий
Капсулы не обладают выраженным сродством к основным красителям, поэтому для обнаружения капсул применяют различные способы приготовления микропрепаратов и их окраски, учитывая особенности образования и сохранения капсул у разных видов бактерий.
Для обнаружения капсулы необходимо наличие окрашенного внутри капсулы фона и окрашенного наружного фона.
Внутренний фон представлен окрашенной микробной клеткой, находящейся внутри капсулы. А наружный фон, окружающий капсулу, может быть естественным или искусственным.
Если микроб сохраняет капсулу постоянно, т.е. не только внутри макроорганизма, но и на питательной среде (клебсиеллы), то препарат для обнаружения капсул можно приготовить из культуры, выращенной in vitro на питательной среде. И в таком случае наружный фон создается искусственно.
Если микроб образует и сохраняет капсулу только внутри макроорганизма (возбудители сибирской язвы, чумы, пневмококки), то в таком случае делается мазок – отпечаток из пораженного органа погибшего макроорганизма (из печени, селезенки, лимфатических узлов) или из мокроты, содержимого бубона, крови. Наружный фон капсулы будет представлен тканевыми клетками.
В том случае, если микропрепарат готовится из исследуемого материала, мазок может быть окрашен одним анилиновым красителем, по методу Грамма, по методу Романовскго – Гимза. В каждом из этих трех споосбов окраски на фоне окрашенных тканевых клеток, будет видна бесцветная капсула, окружающая окрашенную микробную клетку. Обнаружение спор.
Благодаря толщине свое оболочки и плотности содержимого, споры остаются неокрашенными при обработке препарата анилиновыми красителями простым методом или сложным по Граму.
При окраске по Граму или по Леффлеру спора внутри окрашенной цитоплазмы микробной клетки выглядит как зернышко круглой или овальной формы, сильно преломляющее свет.
Существует несколько методов окраски спор (по Циль – Нильсену, по Ганзену, по Ожешко и др.) позволяющих достигнуть контрастной окраски спор в цитоплазме.
Методика окраски микропрепарата:
1) На фиксированный препарат накладывается полоска фильтровальной бумаги (для защиты препарата от оседающих кристаллов красителя) и на нее наливается карболовый фуксин Циля. Препарат осторожно прогревается в течение 3 – 4 минут над пламенем горелки. По мере испарения жидкости краситель добавляется.
2) Фильтровальная бумага снимается и на мазок наносится 2 – 3 капли 5% раствора кислоты (серной, соляной, азотной или уксусной) на 30 секунд.
3) Препарат тщательно промывается струей холодной воды и высушивается.
4) Докрашивается раствором метиленовой сини Леффлера в течение 1 – 2 минут.
5) Препарат промывается струей воды, высушивается и микроскопируется. На голубом фоне цитоплазмы видны сиренево – красные споры.
Этот метод позволяет обнаружить споры не только в процессе их формирования внутри клетки, но и после того как сформированная спора высыпалась из разрушившейся микробной клетки.
Приготовление карболового фуксина Циля:
10 мл. насыщенного спиртового раствора фуксина растворяют в 100 мл 5% раствора карболовой кислоты.
Обнаружение зерен волютина
Зерна волютина (запасные вещества полифосфатной природы) можно обнаружить в клетках многих микроорганизмов.
У бактерий и актиномицетов гранулы волютина располагаются в цитоплазме, у дрожжей и грибов – в вакуолях. Как правило, зерен волютина больше в молодых клетках.
В неокрашенном состоянии крупные зерна волютина выделяются от остальной плазмы большей светопреломляемостью.. Однако лучше наличие зерен волютина определяется в окрашенных препаратах. Для обнаружения зерен волютина применяется окраска метиловой синью по Леффлеру. Зерна волютина при этом окрашиваются в сине – фиолетовый цвет, а протоплазма – в голубой.
Дифференциальная окраска зерен волютина может быть достигнута различными способами окраски, в том числе и способом Нейссера (Neisser). Нейссер разработал и предложил для выявления зерен волютина в клетках дифтерийных бактерий.
При окраске по способу Нейссера зерна волютина окрашиваются в синий или темно – коричневый цвет, а протоплазма – в светло – коричневый.
Зерна волютина можно выявить окраской по способу Омелянского. Для этого на фиксированный мазок наливают карболовый фуксин Циля на 30 секунд. После чего краску сливают, препарат промывают водой и обесцвечивают в течение 30 – 40 секунд 1% раствором серной кислоты. Затем кислоту сливают, препарат промывают водой и докрашивают метиловым синим в разведении 1:40 в течение 30 секунд. После промывки водой препарат высушивают и микроскопируют.
Зерна волютина при этом способе окраски окрашиваются в сиренево – красный цвет и хорошо видны на фоне синей цитоплазмы.
При окраске препарата по методу Грама зерна волютина по тональности и интенсивности окраски не дифференцируются от цитоплазмы, поэтому окраску по методу Грама для выявления зерен волютина применять не имеет смысла.
У некоторых микроорганизмов запасные вещества накапливаются в виде гранул углеводной природы. Их можно выявить при обработке клеток раствором Люголя. Гранулы крахмалоподобных веществ окрашиваются в синий, а гранулы гликогеноподобных полисахаридов – в красновато – коричневый цвет.
Окрашивание микропрепаратов из исследуемого материала
Микропрепараты из крови окрашивают по Романовскому – Гимза, фуксином, метиловым синим или другими анилиновыми красителями.
Для наблюдения вегетативных стадий кишечных простейших пользуются прижизненной окраской паразитов раствором Люголя, слабыми растворами основных красителей (эозин, метиловый синий и др.) в разведении 1:1000 и даже 1: 10000. Для более подробного изучения паразитов, препараты фиксируют жидкими фиксаторами (жидкость Шаудина, метиловый или этиловый спирт) и окрашивают гематоксилином, метиловым синим, фуксином, краской Романовского.
Фиксированные микропрепараты из гнойного содержимого язв, пунктатов бубонов, лимфатических узлов в зависимости от предполагаемого возбудителя окрашивают по Граму, по Бури, по Романовскому – Гимза, серебрением по Морозову.
Какой метод окраски используется для выявления спор
Споры имеют вид образований округлой или овальной формы, находящихся в теле микробной клетки. Различают три вида расположения спор по отношению к длинной оси палочки: центральное — спора находится в центре тела микроба; субтерминальное — спора располагается ближе к одному из ее концов; терминальное — спора располагается на конце палочки. Диаметр споры может не превышать диаметра тела микробной клетки, и форма палочки при спорообразовании не изменяется (бациллы). В других случаях диаметр споры больше поперечного размера микробной клетки, и тело ее в месте образования споры утолщается (клостридии).
Форма, величина и расположение спор постоянны для каждого вида бацилл. В отличие от вегетативной части клетки, споры содержат значительно меньше свободной воды и большое количество липидов и кальция. Плотная оболочка спор, непроницаемая для воды, окрашивается с большим трудом, поэтому при обычных методах окраски споры имеют вид неокрашенных пустот внутри клетки. Для окраски спор пользуются специальными методами с применением протрав (кислоты или щелочи). Протравы разрыхляют оболочку споры, облегчая проникновение в нее красителя. Окрасившиеся споры обладают кислотоустойчивостью, в отличие от вегетативного тела микробной клетки, обесцвечивающегося под действием кислоты. Поэтому принцип окраски спор и кислотоустойчивых бактерий одинаков: препарат окрашивают основным красителем, затем обесцвечивают кислотой и докрашивают дополнительно в какой-нибудь контрастный цвет.
а) Окраска спор методом Ожешко:
• На высушенный нефиксированный препарат (мазок готовится толстым и на краю стекла) наливают несколько капель 0,5% раствора хлористоводородной кислоты (НСl) и подогревают 1-2 мин над пламенем горелки до закипания, после чего остатки кислоты сливают.
• Остывший препарат промывают водой, подсушивают и фиксируют над пламенем горелки.
• Окрашивают карболовым фуксином Циля с подогреванием до появления паров.
• Обесцвечивают 5% раствором серной кислоты в течение нескольких секунд.
• Промывают водой.
• Докрашивают метиленовым синим Леффлера или 1% водным раствором малахитового зеленого 3-5 мин.
Окрашенные споры имеют рубиново-красный цвет, вегетативные тела микробных клеток приобретают цвет дополнительного красителя — голубой при применении метиленового синего или зеленый при использовании малахитового зеленого.
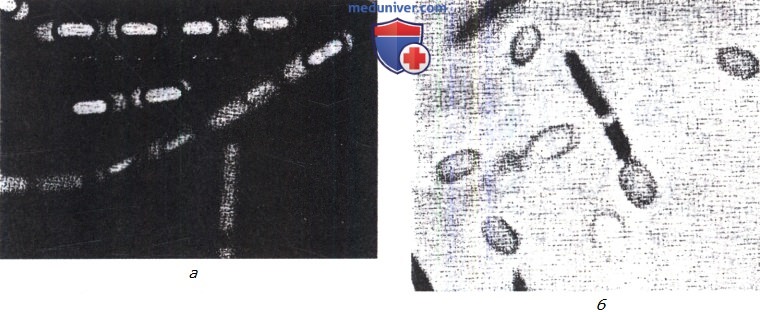
a — Bacillus cereus: удлиненные субтерминальные споры (окраска нигрозином);
б — Clostridium pectinovorum: большие терминальные споры внутри спорангиума и отдельные споры без спорангиума (окраска йодом на гранулезу).
б) Окраска спор методом Пешкова:
• На фиксированный мазок наливают метиленовый синий Леффлера, дают краске закипеть. Окрашивание мазка кипящим красителем производится в течение 20-30 с.
• Препарат промывают водой.
• Докрашивают 0,5% раствором нейтрального красного в течение 30-60 с.
• Промывают водой и высушивают.
Споры, окрашенные метиленовым синим Леффлера, имеют голубой цвет, вегетативные тела бактерий — красный.
в) Окраска спор методом Дорнера:
• Исследуемый мазок высушивают на воздухе.
• Фиксируют над пламенем горелки.
• Покрывают кусочком фильтровальной бумаги, пропитанной карболовым фуксином Циля, поддерживая влажное состояние фильтровальной бумаги добавлением красителя. Мазок подогревают над пламенем горелки 10 мин или помещают стекла на штатив, расположенный над емкостью с кипящей водой.
• Удаляют фильтровальную бумагу и наносят на мазок смесь Никифорова на 1 мин.
• Мазок промывают водопроводной водой, подсушивают фильтровальной бумагой.
• На предметное стекло с мазком наносят насыщенный раствор нигрозина (рецепт 31).
После окраски вегетативные тела остаются бесцветными, а споры приобретают красный цвет. Микробные тела находятся на черном фоне.
Редактор: Искандер Милевски. Дата публикации: 16.05.2019
Какой метод окраски используется для выявления спор
33. Простые и сложные методы окраски микроорганизмов. Способы окраски спор, жгутиков, капсул, включений.
Для окрашивания препаратов пользуются кислыми, щелочными и нейтральными анилиновыми красителями. Наиболее широкое применение нашли основной и кислый фуксин, метиленовый синий, генцианвиолет и везувин.
Простой способ окраски мазков производится водным фуксином Пфейффера и метиленовым синим Леффлера. Готовят водный фуксин из фенолового фуксина Циля, разводя его дистиллированной водой в соотношении 1:10. Состав РАСТВОРА ФУКСИНА ЦИЛЯ: основной фуксин – 1 г; спирт этиловый 96 % – 10 мл; фенол кристаллический – 5 г; глицерин – несколько капель; вода дистиллированная – 100 мл.
Метиленовый синий Леффлера готовят, прибавляя к 30 мл насыщенного раствора метиленового синего (10 г метиленового синего в 100 мл 96 % этилового спирта) 1 мл 1% NaOH или KOH и 100 мл дистиллированной воды.
После окрашивания красители сливают, препарат промывают водой и высушивают между листками фильтровальной бумаги. На сухой мазок наносят каплю масла и микроскопируют с использованием иммерсионного объектива оптического микроскопа. Способность микробов воспринимать красители называется тинкториальными свойствами.
При окраске щелочным метиленовым синим по Леффлеру (3–5 мин) гранулы волютина у дифтерийных коринебактерий приобретают темно–синий, а палочка – голубой цвет.
При сложных методах окраски мазков применяют два–три различных по цвету красителя, что позволяет дифференцировать микробы и выявить некоторые нюансы в деталях их строения. К таким методам относят окраску по Граму, Цилю–Нельсену, Нейссеру, Бурри–Гинсу, Романовскому–Гимзе и некоторые другие.
При окраске по НЕЙССЕРУ гранулы ВОЛЮТИНА у дифтерийных коринебактерий окрашиваются в сине–черный, а бактерия – в желтый цвет. Мазок окрашивают: 1) 1 мин уксуснокислым метиленовым синим (метиленовый синий – 0,1 г, спирт – 2 мл, ледяная уксусная кислота – 5 мл, дистиллированная вода – 100 мл); 2) сливают краситель и мазок промывают водой; 3) на 20– 30 с наносят раствор Люголя; 4) 1 –3 мин окрашивают везувином (прокипяченная и отфильтрованная взвесь 2 г везувина в смеси 60 мл спирта и 40 мл дистиллированной воды).
Количественное содержание ПЕПТИДОГЛИКАНА, содержащегося в # стенке, определяет характер окраски бактерий и других прокариот по ГРАМУ. Те из них, которые содержат в клеточной стенке большое его количество (около 90 % пептидогликана), окрашиваются по Граму в сине–фиолетовый цвет и их называют грамположительными, все другие, содержащие в оболочке 5–20 % пептидогликана, – в розовый цвет и их называют грамотрицательными. Толщина слоя пептидогликана в клеточной стенке грамположительных бактерий в несколько раз больше, чем у грамотрицательных. Техника окраски по Граму: 1. Фиксированный мазок 1–2 мин окрашивают раствором генцианвиолета (генцианвиолет – 1 г, этанол 96 % – 10 мл, фенол кристаллический – 2 г, вода дистиллированная – 100 мл; по методу Синева его покрывают пропитанной тем же красителем полоской фильтровальной бумаги, которую смачивают 2–3 каплями воды). 2. Слив генцианвиолет (сняв полоску бумаги Синева), мазок 1 мин обрабатывают раствором Люголя и, не промывая водой, сливают его. 3. Обесцвечивают спиртом в течение 0,5 мин, промывают водой. 4. Окрашивают 1–2 мин фуксином Пфейффера. 5. Мазок ополаскивают водой и высушивают.
Для выявления грамположительных КИСЛОТО– И СПИРТОУСТОЙЧИВЫХ микобактерий туберкулеза и лепры, которые из–за большого количества в клеточных оболочках жировосковых веществ, миколовой кислоты и других оксикислот непроницаемы для разведенных растворов красителей, используют окраску по методу ЦИЛЯ – НИЛЬСЕНА. Окрашивание их по этому способу достигается при помощи концентрированного фенолового фуксина Циля с подогреванием над пламенем горелки до закипания и отхождения паров. Окрашенные с применением термокислотной обработки микобактерии не обесцвечиваются слабыми растворами минеральных кислот и этилового спирта. Техника окраски. 1. Фиксированный мазок покрывают полоской фильтровальной бумаги, на которую наносят фуксин Циля, и несколько раз подогревают над пламенем горелки до появления паров, подливая краситель, далее бумагу снимают и промывают водой. 2. Препарат обрабатывают (обесцвечивают) 5 % раствором серной кислоты и промывают водой. 3. На мазок наливают водно–спиртовой раствор метиленового синего, спустя 3–5 мин промывают водой и высушивают. Кислотоустойчивые бактерии окрашиваются в интенсивно красный цвет, остальные виды микробов, обесцвечивающиеся в процессе обработки препарата кислотой, – в светло–синий.
При необходимости дифференциации возбудителей лепры от микобактерии туберкулеза используют окраску мазков по методу Семеновича–Марциновского – микобактерии лепры окрашиваются в красный цвет, а микобактерии туберкулеза остаются неокрашенными.
Для обнаружения КАПСУЛ бактерий, плохо воспринимающих красители, используют метод БУРРИ–ГИНСА: в каплю туши, разведенной в 10 раз водой, вносят исследуемые бактерии и равномерно распределяют их петлей по предметному стеклу; мазок высушивают, фиксируют (наносят 2–3 капли спирта и сжигают его на стекле), окрашивают в течение 3–5 мин фуксином Пфейффера, промывают водой, высушивают; на темном фоне препарата капсулы видны в виде светлых ореолов вокруг красных бактерий.
О наличии ЖГУТИКОВ чаще всего судят по направленному характеру движения бактерий в раздавленной и висячей каплях. Но можно использовать и некоторые методы окраски, например по МОРОЗОВУ: 1) обработка препарата кислотой, при этом оболочки и жгутики разрыхляются; 2) закрепление разрыхленных структур танином; 3) обработка азотнокислым серебром, оно окутывает каждый жгутик и саму # толстым слоем, давая различные оттенки от жёлтого до тёмно-коричневого.
СПОРЫ. Эндоспоры бактерий выдерживают длительное кипячение, действие горячего воздуха (140–150°С) и химических дезинфицирующих веществ, многие годы сохраняются в почве, на растительности и предметах. Попадая в организм человека и животных, споры патогенных бактерий прорастают в материнские клетки за несколько часов.
Водным фуксином, водно–спиртовым метиленовым синим и по Граму эндоспоры не окрашиваются, так как их плотная многослойная оболочка непроницаема для обычных красителей. В мазках из патологических материалов, культур бацилл и клостридии, окрашенных простыми красителями, споры выглядят в виде бесцветных телец внутри окрашенных в соответствующий цвет вегетативных клеток или вне их. Окрашивать их можно по методу Циля–Нельсена, используя для обесцвечивания мазков после обработки их фуксином Циля не 5%, а 1% серную кислоту. При этом эндоспоры, так же как микобактерии туберкулеза, красятся в розовый цвет и будут хорошо видны на синем фоне бактерий. Для окрашивания спор можно использовать метод по ОЖЕШКО: 1) протравка оболочки споры горячей кислотой; 2) окраска по Цилю–Нильсену.
При исследовании морфологии паразитов крови (спирохеты – бледная трепонема, простейшие – малярийный плазмодий), а т/же ФЭ, используют окраску по РОМАНОВСКОМУ–ГИМЗА. Краска состоит из смеси азура, эозина и метиленовой сини. Окрашивает ЦИТОПЛАЦМУ в голубой, а ЯДРА в красно–фиолетовый цвет. Этот метод позволяет обнаружить различные цитологические детали.
Мазок для люминесцентной микроскопии готовят обычным образом, фиксируют в ацетоне и наносят на него флюорохром на 20–30 мин. Сделанный препарат промывают проточной водой, покрывают покровным стеклом и микроскопируют.