какой метод можно использовать для выявления мутаций
Генетические нарушения у человека и методы их выявления
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. 
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Какой метод можно использовать для выявления мутаций
Существуют различные методы, позволяющие выявлять генетические мутации. Блоттинг по Саузерну, описанный выше, используют для определения крупных геномных мутаций. В других методах применяют ПЦР-амплифицированную или клонированную ДНК Мутации могут быть обнаружены непосредственно с помощью секвенирования (определения первичной структуры макромолекул ДНК) или с использованием радиоизотопных и флюоресцентных систем.
Они также могут быть выявлены при сравнении последовательности опухолевой ДНК с ДНК, выделенной из нормальных тканей, или путем сравнения с последовательностью нормальной ДНК, описанной в литературе (например, в базах данных, размещенных в Интернете).
Анализ конформационного полиморфизма одноцепочечной ДНК — радиоизотопная методика определения мутаций, основанная на изменении формы (конформации) мутантной ДНК, которые могут быть выявлены при электрофорезе. Для этого нормальную и опухолевую ДНК клонируют с помощью ПЦР, денатурируют и исследуют с помощью гель-электрофреза. Мутантная ДНК меняет свою конформацию, принимая форму, отличную от нормальной, и приобретает отличную от нормальной подвижность при электрофорезе.
Эти изменения легко определяются при радиоавтографии. Рисунок ниже иллюстрирует методику анализа конформационного полиморфизма одноцепочечной (однонитевой) ДНК.
Денатурационная высокоэффективная жидкостная хроматография — новый метод выявления мутаций, не требующий применения радиоактивных веществ. При этом исследовании нормальную и опухолевую ДНК амплифицируют (клонируют) с помощью ПЦР, смешивают и денатурируют для образования смеси одноцепочечных молекул ДНК. Затем проводится медленный отжиг, в результате которого вновь образуется двунитевая ДНК.
При спаривании нити нормальной ДНК с нитью опухолевой в месте мутации происходит нарушение спаривания — так называемый гетеродуплскс. Этот гетеродуплекс обладает температурой плавления, отличающейся от таковой для нормальной и опухолевой ДНК, т. с. гомодуплексных молекул, и благодаря этому его можно легко определить с помощью хроматографии.
Другие методы выявления мутаций — денатурирующий градиентный гель-электрофорез, аллель-специфический олигонуклеотидный анализ и аллель-специфическая амплификация — основаны на выявлении разницы в последовательностях нормальной и опухолевой ДНК.
Каждый из этих методов (за исключением прямого секвенирования) представляет собой средство скрининга на наличие мутации, но не определяет ее тип или характер нарушения последовательности. В настоящее время разработаны приборы и методы, позволяющие исследовать крупные фрагменты генома и экспоненциально повышающие наши возможности в выявлении мутаций.
К ним относятся молекулярно-генетический анализ ДНК (microarray analysis) с помощью генных чипов, или биочипов, и трансгеномная система WAVE DNA Fragmentation Analysis System, разработанная в Калифорнии компанией Transgenomic.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Научная электронная библиотека
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
6.2. Цитогенетические и молекулярно-цитогенетические методы
Среди наиболее распространенных мутаций у человека являются хромосомые. Показано, что хромосомная патология составляет 30 % от общего числа пороков развития у новорожденных, до 45–70 % всех случаев спонтанных абортов (до 15-й недели беременности) и 6–7 % мертворожденных детей этиологически связаны с хромосомными аномалиями. Среди недоношенных детей частота хромосомных аномалий достигает 7:1000. Причем, среди недоношенных детей с врожденными пороками развития уровень хромосомных аномалий достигает 18 %, а при наличии комплексных врожденных пороков – более 45 %. В среднем аномалии кариотипа встречаются у 15 % детей с недифференцированными формами умственной отсталости, врожденными пороками и/или микроаномалиями развития. Поэтому, неудивительно, что особое место в медицинской генетике занимают методы их выявления, разрешающая способность которых различна (табл. 7).
Диагностика хромосомных аномалий проводится с использованием цитогенетических методов, которые включают в себя культивирование с целью получения метафазных клеток с последующим применением дифференциального окрашивания хромосом по длине и исследованием кариотипа с помощью светового микроскопа. Данный комплекс приемов получил широкое распространение в связи с тем, что в течение долгих лет он представлял собой практически единственный способ идентификации хромосомных аномалий. Существует несколько типов дифференциального окрашивания хромосом по длине. Они определяют единую линейную дифференциацию структуры хромосом в метафазе митоза, при этом каждый метод окрашивания имеет свои характерные особенности, и существует в нескольких модификациях. Следует отметить, что они не являются альтернативными. Наиболее распространенным методом дифференциального окрашивания хромосом является G-окрашивание. Он базируется на предварительной обработке препаратов хромосом перед окраской и на использовании нефлюоресцентных красителей или их смесей. Предварительная обработка связана с инкубацией в солевых растворах и в растворах протеолитических ферментов (взаимодействующих, по-видимому, с белковой компонентой хроматина). Идентификацию хромосом обеспечивает чередование темно и светло окрашенных полос. По числу, величине и расположению полос (сегментов) можно определить изменения в хромосомном наборе (кариотипе). Число полос на гаплоидный кариотип при G-окрашивании варьирует, но в метафазной клетке их число не менее 320, а на стадии прометафазы может достигать и 1250. Существуют также и методы, которые окрашивают определённые участки хромосом (например, С-окрашивание, с помощью которого анализируются гетерохроматиновые участки). Применение последних также необходимо при идентификации хромосомных аномалий или дифференциации между хромосомными мутациями и морфологическими особенностями хромосом. Однако в ряде случаев применение цитогенетического анализа метафазных хромосом бывает затруднено или невозможно (сложность культивирования клеток большинства соматических тканей; диагностика хромосомных микроаберраций). Следует напомнить, что разрешающая способность этого метода – 5–7 млн пн.
С развитием медицинской генетики и совершенствованием микроскопической техники был разработан целый ряд новых технологий, основанных на принципах гибридизации нуклеиновых кислот на препарате, применение которых позволило в значительной степени увеличить эффективность выявления хромосомных аномалий, а в ряде случаев можно заменить цитогенетический анализ определенным молекулярно-цитогенетическим. Использование соответствующего молекулярно-цитогенетического метода зависит от разрешающей способности технологии. Биомедицинское направление, целью которого явилось изучения хромосом с помощью последних достижений в области молекулярной биологии, сформировалось как наука и получило название молекулярная цитогенетика.
Среди самых распространенных молекулярно-цитогенетических методов известны: флюоресцентная гибридизация in situ (fluorescence in situ hybridization – FISH) и сравнительная геномная гибридизация (comparative genomic hybridization – CGH). Как несложно заметить, оба эти метода основаны на процессе гибридизации нуклеиновых кислот. Гибридизация in situ основана на взаимодействии однонитевых последовательностей экзогенной ДНК, меченной флюорохромами (флюоресцирующими веществами) – ДНК пробы, и исследуемой ДНК. Разрешающая способность молекулярно-цитогенетических методов определяется минимальным размером последовательности хромосомной ДНК (количеством нуклеотидов), которую возможно регистрировать с помощью микроскопа или другой системы детекции. В качестве стандарта при молекулярно-цитогенетическом анализе используются цитогенетические методы.
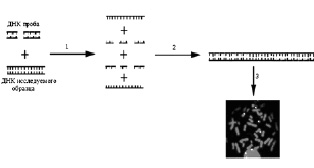
Схема проведения FISH представлена на рис. 19. Первой стадией FISH является денатурация – процесс получения однонитевых последовательностей ДНК. Следующей стадией является гибридизация – реакция воссоединения однонитевых последовательностей ДНК зонда и ДНК, находящейся на цитологическом препарате в составе метафазных хромосом и интерфазных ядер, с образованием двунитевых молекул ДНК. В результате появляется возможность анализа флюоресцирующих последовательностей ДНК на предметном стекле с помощью флюоресцентного микроскопа.
Рис. 19. Схематическое изображение метода FISH:
1 – смесь ДНК пробы и ДНК исследуемого образца денатурируется при температуре 72–75 °С, в результате чего получается смесь однонитевых последовательностей ДНК; 2 – гибридизация ДНК пробы и исследуемого образца: меченая ДНК проба встраивается в ДНК исследуемого образца на препарате хромосом; 3 – детекция меченой ДНК in situ с помощью флюоресцентного микроскопа
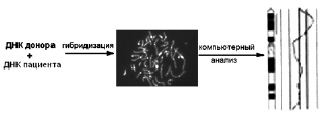
Идентичный принцип лежит также в основе метода HR CGH, схема которого представлена на рис. 20. Отличие заключается лишь в том, что в случае CGH гибридизация на хромосомах in situ проводится с использованием смеси меченых одним флюорохромом геномной ДНК пациента и другим флюорохромом ДНК донора (при исследовании численных хромосомных аномалий) или геномной ДНК пациента и ДНК какой-то конкретной хромосомы донора (при исследовании структурных хромосомных аномалий). Затем с помощью цифрового анализа производится сравнительная оценка интенсивности суперпозиции сигналов двух разных флюорохромов, в результате чего становится
возможным определение приобретения или потери последовательностей ДНК у пациента в строго определенных хромосомах. На рис. 21 показан результат проведения классической метафазной сравнительной геномной гибридизации (HR CGH) ребёнку с умственной отсталостью и МАР.
Рис. 20. Схематическое изображение метода классической CGH на метафазных хромосомах: гибридизация двух меченых разными красителями образцов тотальной ДНК (пациента и донора) происходит так, как и в случае FISH. Затем, соотношение интенсивностей результатов гибридизации ДНК пациента и донора на метафазных хромосомах анализируется с помощью компьютера. Соотношение 1:1 соответствует норме; 1 (донор):0,5 (пациент) – делеции; 1 (донор):1,5 (пациент) – дупликации
В настоящее время известен целый комплекс модификаций FISH. Практически все разновидности метода FISH являются взаимодополняющими при диагностике хромосомных аномалий, поскольку существует достаточно большое количество флюорохромов с различными свойствами. Имеется возможность детекции множества последовательностей ДНК на цитологическом препарате за счет того, что каждая из ДНК проб будет мечена определенным цветом (многоцветовая FISH или MFISH). Тем не менее, одноцветовая FISH является одним из основных среди всех молекулярно-цитогенетических методов. Спектр применения данного метода в значительной степени широк: от диагностики самых распространенных численных хромосомных аномалий (например, синдром Дауна и его мозаичные формы) до идентификации редких структурных хромосомных перестроек при недифференцированных формах наследственной патологии. Особое внимание заслуживает одноцветовая FISH с использованием ДНК проб, маркирующих полностью пару гомологичных хромосом. Этот метод применяется преимущественно для идентификации сложных хромосомных перестроек, реже, он используется для определения численных хромосомных аномалий.
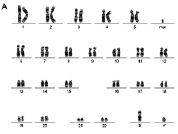
Рис. 21. Результаты проведения HR CGH ребенку с умственной отсталостью и МАР:
А – цитогенетическое исследование [кариотип: 47,XY,+mar]; Б – молекулярно-цитогенетическое исследование: обнаружено увеличение числа копий последовательностей ДНК (трипликация) короткого плеча хромосомы 18 [ish cgh enh(18)(p11.1pter)*]. Примечание. *запись результата в соответствии с международной номенклатурой ISCN 2013
MFISH основывается на создании смеси ДНК проб, меченных различными флюорохромами, которые одновременно вводятся в исследуемый препарат с последующей совместной гибридизацией. Изначально данный метод разрабатывался для идентификации хромосомных аномалий при отсутствии клинического диагноза из-за значительной экономии затрачиваемого экспериментального времени на анализ. Помимо этого, данный метод является эффективным для определения структурных хромосомных аномалий за счет одновременной визуализации нескольких участков хромосом. На базе ранних разработок MFISH были созданы такие высокоразрешающие методы идентификации хромосомных аномалий, как 24-цветовая FISH и спектральное кариотипирование (SKY – spectral karyotyping). Данные методы используют комбинацию из 24-х ДНК проб, меченных разными флюорохромами, которые соответствуют каждой гомологичной аутосоме и половым хромосомам. Различие их заключается в том, что для SKY используются специальные спектральные системы детекции, а для 24-цветовой FISH применяется цифровой анализ изображения, целью которого является создание соответствующей комбинации цветов, в результате чего каждая хромосома имеет свою характерную окраску. Использование технологий, основанных на микроманипуляции микроскопическими объектами, позволило создать коллекцию ДНК проб, маркирующих одновременно участки хромосом, соответствующие полосам G-окрашивания. Подобные коллекции обычно состоят из нескольких сотен проб и их применение позволяет получить разноцветное сегментное окрашивание всех хромосом с высоким разрешением. MCB FISH (multicolor banding FISH) представляет собой высокоэффективный метод диагностики сложных структурных хромосомных перестроек и микроаберраций.
В настоящее время существует целый ряд модификаций CGH, применение которых рассматривается в качестве оправданных при ряде диагностических процедур. Как уже было сказано, применение методов зависит от их разрешающей способности, оценивающейся числом последовательностей ДНК, которая представлена в табл. 7. Классический CGH анализ был внедрен в молекулярно-цитогенетическую практику для анализа хромосомного набора в клетках тканей, культивирование которых затруднено или невозможно. Среди основных ограничений CGH необходимо отметить невозможность диагностики хромосомного мозаицизма и сбалансированных структурных хромосомных перестроек. Разработка модификаций метода CGH была направлена на создание протоколов для высокоразрешающей идентификации хромосомных микроаберраций (микроделеций и микродупликаций). В результате этого были созданы методы серийного CGH анализа (серийная CGH или arrayCGH). Серийный CGH анализ основан не на гибридизации тотальной геномной ДНК донора и пациента, а на применении в качестве ДНК донора специфических последовательностей ДНК, соответствующих определенным участкам хромосом. Схема проведения arrayCGH (молекулярного кариотипирования) представлена на рис. 22. CGH проводится несколькими сериями с использованием цифровых систем детекции и анализа сравнительной интенсивности сигналов. Методы, основанные на серийной CGH, позволяют проводить идентификацию хромосомных микроаберраций, а также генных мутаций, затрагивающих последовательности ДНК, размер которых больше 50 пн. На рис. 23 показан результат проведения arrayCGH ребенку с дополнительным материалом на хромосоме 1.
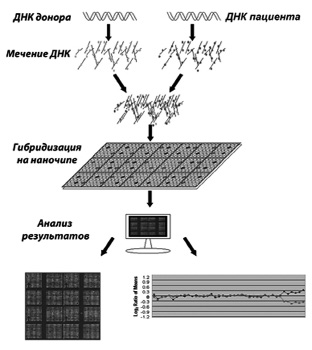
Рис. 22. Схематическое изображение метода arrayCGH:
ДНК пациента и донора метятся разными флюорохромами; затем проводится гибридизация на наночипе, а далее результаты сканируются и анализируются с помощью специальных систем – «лазерный сканер + компьютер»
Одним из наиболее используемых методов молекулярно-цитогенетической диагностики является интерфазная FISH на препаратах культивированных и некультивированных клеток. Данный метод нашел широкое применение в идентификации хромосомных аномалий при различных заболеваниях, многие из которых сопровождаются нарушением психики. Среди преимуществ данного метода следует отметить высокую эффективность определения регулярных и мозаичных форм фактически любой хромосомной патологии. Дополнительным преимуществом этого метода является возможность проведения анализа непосредственно на предметном стекле, которое можно было использовать при классическом цитогенетическом анализе (культивирование клеток исследуемой ткани, дифференциальное окрашивание хромосом, исследование кариотипа с помощью светового микроскопа). Невозможность культивирования большинства клеток тканей человека ограничивает FISH анализ на метафазных хромосомах. В результате чего и был разработан метод FISH на интерфазных ядрах или интерфазная FISH. Этот метод в значительной степени более эффективен по сравнению с FISH анализом метафазных хромосом при идентификации мозаичных форм численных хромосомных аномалий, поскольку позволяет легко изучить большое число клеток (до нескольких десятков тысяч). Недостатком этого метода является сложность в определении структурных хромосомных аномалий. На рис. 24 показан пример использования метода FISH на интерфазных клетках.
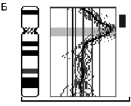
Рис. 23. Результаты молекулярно-цитогенетического исследования дополнительного материала неизвестного происхождения на длинном плече хромосомы 1:А – цитогенетический анализ [кариотип ребёнка: 46,XX,add(1)(q4?4)]; Б – исследование методом arrayCGH участка длинного плеча хромосомы 1 и хромосомы 16
Рис. 24. Пример использования метода FISH, демонстрирующий наличие двух хромосом в клетке (норма) и трех хромосом Х (трисомия хромосомы Х). Слева видны: три сигнала, соответствующие трем хромосомам Х (трисомия), справа – два сигнала – двум хромосомам Х (норма)
Как уже отмечалось, одним из основных направлений развития методологических подходов к разработке новых вариантов FISH является создание ДНК проб с различными свойствами, связанными с их молекулярным составом и локализацией на хромосомах. Среди ДНК проб для метода FISH можно выделить следующие: ДНК пробы, состоящие из высокоповторяющихся последовательностей ДНК; ДНК пробы, состоящие из уникальных последовательностей ДНК генов; WCP ДНК пробы (whole chromosome probe – проба, маркирующая хромосому полностью) и 24-цветовая FISH/SKY (набор из 24-х WCP ДНК проб); ДНК пробы, состоящие из участков хромосом (MCB FISH) для MFISH. Наиболее частая процедура в клинической практике – FISH с использованием ДНК проб, состоящих из высокоповторяющихся последовательностей ДНК, для идентификации численных хромосомных аномалий. FISH с применением ДНК проб, состоящих из уникальных последовательностей ДНК, является методом идентификации и локализации структурных хромосомных аномалий и определения изменения ДНК на субхромосомном уровне (выявление точек разрыва). FISH с использованием WCP ДНК проб и 24-цветовая FISH/SKY (набор из 24-х WCP ДНК проб) являются дополнительными методами диагностики структурных хромосомных аномалий. Эти методы, в основном, используются для уточнения диагноза при наличии перестройки с участием нескольких хромосом. Они также могут быть использованы при диагностике транслокаций небольших участков хромосом. MCB FISH является высокоэффективным методом идентификации сложных структурных хромосомных перестроек и хромосомных микроаберраций.
CGH анализ нашел своё применение в области онкоцитогенетики и диагностики хромосомных микроаберраций у детей с умственной отсталостью. Помимо этого, серийный CGH анализ позволяет с высокой эффективностью определить потерю (делеции) или приобретение (дупликации) последовательности хромосомной ДНК размером менее одного млн пн (геномные аномалии).
Необходимо знать, что при постнатальной диагностике хромосомных аномалий молекулярно-цитогенетические методы являются дополнительными к классическим цитогенетическим. Инициирующей стадией диагностики хромосомных аномалий обычно является классический цитогенетический анализ, включающий в себя культивирование исследуемых клеток с целью получения метафазных пластинок с последующим применением методов дифференциального окрашивания хромосом по длине и исследованием кариотипа с помощью светового микроскопа. Данный метод позволяет идентифицировать или предположить наличие хромосомной аномалии. При необходимости, исходя из предположения, применяется молекулярно-цитогенетическая диагностика. При этом выбирается участок хромосомы, последовательности ДНК которого маркирует соответствующая проба. После этого проводится молекулярно-цитогенетический анализ. Следует отметить и то, что сложные хромосомные перестройки требуют применения нескольких модификаций FISH.
Особого внимания заслуживает молекулярно-цитогенетическая диагностика субтеломерных хромосомных микроаберраций. Частота данных хромосомных аномалий может достигать 5–25 % в группах детей с недифференцированными формами умственной отсталости и нарушением психики. До создания коллекций ДНК проб, маркирующих соответствующие участки хромосом, диагностика этой патологии оставалась невозможной. Получение набора ДНК проб, маркирующих все субтеломерные участки, позволило с высокой эффективностью обнаружить данную форму хромосомной патологии. Другой возможностью идентификации хромосомных микроаберраций является применение различных вариантов метода CGH. Многие исследователи отмечают и то, что метод серийной CGH (молекулярного кариотипирования) является в значительной степени эффективным для диагностики субтеломерных хромосомных микроаберраций. Альтернативным методом диагностики субтеломерных хромосомных микроаберраций, предложенным отечественными исследователями, является использование FISH и ДНК зондов, маркирующих субтеломерные участки хромосом.
В настоящее время известны многие клинические характеристики пациентов с субтеломерными микроаберрациями различных хромосом. Благодаря этому, становится возможным теоретически выделить ту хромосому, в которой с наибольшей вероятностью расположена микроаберрация, в результате исчезает необходимость одновременного использования нескольких зондов и анализ производится с использованием лишь одной субтеломерной ДНК пробы.
Таким образом, генетические нарушения, выявляемые у индивидуумов, достаточно гетерогенны. Причинами этих нарушений нередко могут быть различные хромосомные (геномные) микроперестройки, которые невозможно выявить с применением стандартных цитогенетических методов из-за не слишком высокого уровня разрешения этой классической технологии. С разработкой современных технологий многие ученые считают, как говорилось выше, что субтеломерные и интерстициальные перестройки могут являться причиной более 5–10 % случаев недифференцированной умственной отсталости при условии их выявления с использованием высокоразрешающего сканирования генома методом arrayCGH (с разрешением не менее 100 тыс. пн). Они также предполагают, что применение высокоразрешающих методов сканирования генома увеличивают удельный вес субтеломерных и интерстициальных перестроек в 1,5–2 раза.
Показано, что исследования больных с недифференцированными формами умственной отсталости и аутизмом, проведенные с помощью современных молекулярно-цитогенетических методов, способствуют более корректному определению структурных особенностей генома и при определении генетических причин позволяют классифицировать недифференцированные формы. Кроме того, подобные исследования имеют практическую значимость, а именно, благодаря им определены показания для проведения молекулярного кариотипирования (arrayCGH), определяется тактика проведения молекулярно-цитогенетических исследований, что в дальнейшем способствует эффективному медико-генетическому консультированию, а в отдельных случаях и пренатальной диагностики.
Суммируя результаты наших исследований, можно сказать, что мы обследовали более 1000 пациентов с недифференцированными формами умственной отсталости различными молекулярно-цитогенетическими методами. Учитывая данные, полученные с помощью цитогенетических исследований (их было более 9 тысяч) и частично подтвержденные с использованием FISH и MCB, различные хромосомные аномалии были выявлены в 10,6 % случаев. Принимая во внимание наличие у некоторых детей хромосомной нестабильности в виде анеуплоидии аутосом и гоносом, хромосомных перестроек (транслокаций, делеций, сайтов ломкости и т.д.), можно сказать и о том, что мозаичные хромосомные аномалии, включая низкопроцентный мозаицизм и хромосомную нестабильность, имеют относительно повышенную частоту среди детей с умственной отсталостью, ВПР и/или МАР, и этим пациентам требуется проведение исследования с использованием нескольких методов, а именно цитогенетических и молекулярно-цитогенетических технологий (HR CGH и arrayCGH). Обсуждая данные, полученные в наших лабораториях при использовании HR CGH, сделано заключение о том, что этот метод является эффективным для выявления хромосомных микроаномалий (эффективность более 40 %), и может быть использован для анализа геномных перестроек, связанных с умственной отсталостью и аутизмом. Однако в связи с такими ограничениями этого метода, как невозможность подтверждения (исключения) низкопроцентного мозаицизма, сбалансированных транслокаций, а также микроделеционных синдромов в тех случаях, когда размер перестройки является ниже разрешения HR CGH метода, применяется метод arrayCGH. При этом микроаномалии хромосом (генома) обнаружены в 48 % случаев, а в 37 % случаев были выявлены вариации числа копий последовательностей ДНК (CNV). Методом arrayCGH также были подтверждены и/или уточнены точки разрыва, предположенные с помощью цитогенетических и других молекулярно-цитогенетических методов. Микроаномалии и/или вариации числа копий последовательностей ДНК затрагивали все хромосомы и довольно большое число генов, которые могут быть ассоциированы с недифференцированными формами умственной отсталости. Нами был сделан вывод о том, что патогенез умственной отсталости связан со многими генами и, практически, со всеми хромосомами, и заболевание следует рассматривать в плане геномных сетей и генных взаимодействий, т.е. как связанное со специфическим комплексом процессов, в которые вовлекаются от нескольких десятков до нескольких тысяч генов. Единичные аномалии у индивидуумов с наследственными недифференцированными формами (например, с умственной отсталостью) указывают, скорее всего, на одно из звеньев патогенетического каскада, а не на специфическую перестройку, характерную для заболевания. Вероятно, к изучению многих недифференцированных форм предположительно наследственных заболеваний следует подходить с точки зрения персонифицированной геномной медицины, т.е. основываясь на идентификации индивидуальных особенностей вариаций генома на молекулярном и клеточном уровнях (см рекомендуемую литературу). Таким образом, следует подходить к клиническому анализу больного персонализировано, используя все современные геномные и клеточные технологии в диагностике. Становится всё более и более очевидным, что патогенез, связанный со многими генами, необходимо рассматривать в плане геномных сетей и геномных взаимодействий. Предлагаемый биоинформатический
(in silico) подход к анализу геномых перестроек позволяет определить возможные гены-кандидаты и молекулярные «процессы-мишени», связанные с патогенезом наследственных нервных и психических заболеваний. Анализируя наиболее известные методы поиска этиологических факторов недифференцированных форм, можно сделать вывод о том, что сочетание высокоразрешающих молекулярно-цитогенетических методов и in silico анализа может считаться наиболее удачной комбинацией для поиска генетических причин недифференцированных форм наследственных заболеваний.
Кроме того, применение цитогенетических и молекулярно-цитогенетических методов, направленных на идентификацию хромосомных (геномных) микроаномалий, позволяет не только выявлять те или иные численные и структурные изменения генома, но также картировать гены-кандидаты данной формы нарушения психики. Таким образом, анализ геномных вариаций и микроаномалий хромосом (генома), обнаруженных современными молекулярно-цитогенетическими методами, представляет несомненный интерес для выявления причин заболеваний и фактически дифференцирования изучаемых форм, определения их генетических маркеров, а также дальнейшего поиска генетических и эпигенетических механизмов патологии головного мозга.
Знание молекулярных и клинических основ наследственных болезней, а также знакомство с рекомендуемой литературой, помогут исследователям с высшим медицинским, биологическим и психологическим образованием постигать основы медицинской генетики и успешно работать в подразделениях генетического профиля педиатрических, психиатрических и психологических учреждений, а также в медико-генетических консультациях.