какой металл загорается в холодной воде
Теперь понятно почему его звали Кальцифер
совершенно невинный вопрос: а в бензине он тоже воспламеняется?)
было бы шикарно запустить лепёшку калия по воде =D
Вулкан Бёттгера. Эксперимент. (запись №6)
Окислителем является хром ( VI ), который в результате реакции превращается в хром ( III ). В результате этого образуется зеленый оксид хрома.
(NH4)2Cr2O7 = N2 + 4H2O + Cr2 O 3
Ученый решил провести опыты по способности вещества взрываться от удара и загораться от лучины. При ударе кристаллы дихромата аммония превратились в порошок.
После чего ученый поднес к горке порошка горящую лучину. Возгорания не произошло, но вокруг лучинки начали подпрыгивать раскаленные частицы вещества, а горка начала увеличиваться.
Также изменился ее цвет, он стал зеленым.
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) и при взаимодействии с водой.
Дихромат аммония до термической реакции (фото из интернета, не мое)
Хлорка и антифриз (не повторять. )
Решили мы набрать хлорки в бутылку, в бутылке оставалось немного антифриза, пошла реакция. Ну как же не попробовать бахнуть
Переозвучивает сам. Произношение настолько плохое, что это даже хорошо, ибо народ кайфует с его русского акцента.
Про оговорку во фразе This results in beautiful hedgehog.
В качестве достоинств иностранный зритель отмечает, что тут есть настоящие эксперименты над теми веществами, о которых в ролике идёт речь.
Для примера видео про олово, от которого я узнал про существование второго канала.
Обычно это вещество используется в качестве сельскохозяйственного удобрения.
Однако, чтобы произошла катастрофа, подобная взрыву в Бейруте, многое должно было пойти не так. К сожалению, именно это и случилось в ливанской столице.
Сам по себе нитрат аммония не горит. Вместо этого, он действует как источник кислорода, который может ускорить горение других материалов.
Взрыв аммиачной селитры производит огромное количество оксидов азота. Диоксид азота (NO₂) — красный газ с неприятным запахом. Ролики из Бейрута показывают отчетливый красноватый цвет шлейфа газов от взрыва.
Джеффри Льюис, эксперт по ядерному оружию из Института международных исследований Миддлбери в Калифорнии, оценил мощность взрыва в Бейруте «от 200 до 500 тонн в тротиловом эквиваленте, учитывая ущерб от взрыва, ударную волну, сейсмические сигналы и размер воронки».
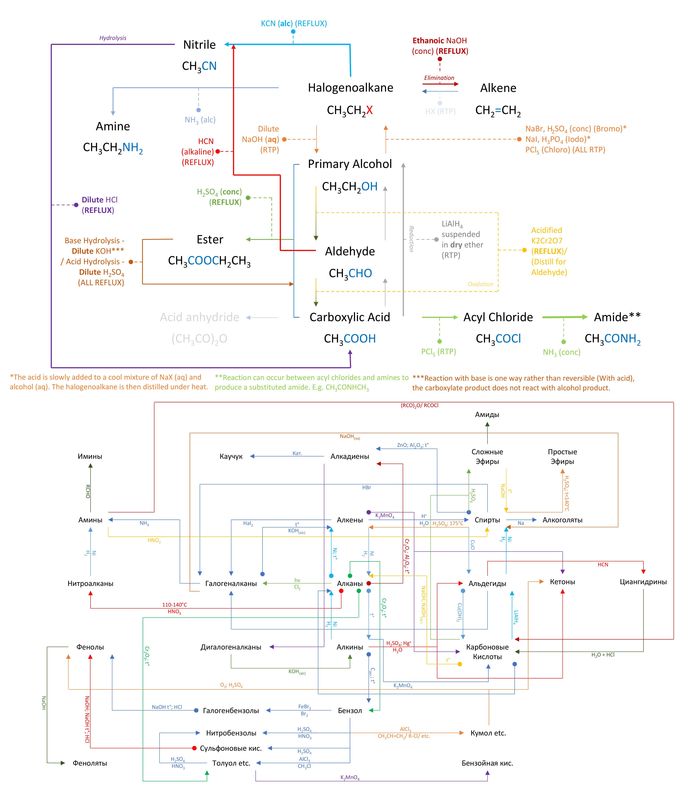
Разница в цепочках реакций по химии между Великобританским A-level и Русским ЕГЭ (Обе программы сдаются в 18 лет)
Иод в гифках
Если ёмкость с газообразным иодом накрыть охлаждённой колбой, то кристаллы будут формироваться прямо на её стенке
Существует заблуждение, что у иода нет в принципе жидкого агрегатного состояния, однако его можно получить, если в пробирке с веществом поддерживать температуру между 114°C и 184°C
(или же нагревать иод в условиях повышенного давления)
Реакция иода с металлическим рубидием
Иод растворяется в воде плохо, но хорошо в неполярных растворителях (например в циклогексане)
Образование иодоформа при добавлении гидроксида натрия к спиртовой настойке йода
Термическое разложение пентаоксида дииода
Реакция порошка алюминия с пентаоксидом дииода при нагревании
Взрыв нитрида трииода от механического воздействия
Реакция трихлорида иода с декабораном
Смесь перекиси водорода и серной кислоты добавляют к смеси иодида калия, тиосульфата натрия и крахмала. Происходят реакции окисления иодида до иода и одновременное его же восстановления тиосульфатом обратно до иодида. Как только тиосульфат заканчивается и иодид перестает образовываться, раствор мгновенно темнеет из-за получившегося комплекса с крахмалом.
Предыдущие посты серии:
P.S. Элемент называется именно иод (иодиды, иодоводород, иодная к-та и пр.)
Учительница года
Бром в гифках
Реакция брома с алюминием
Реакция брома с металлическим натрием
Реакция брома с красным фосфором
Реакция брома с кремнием
Реакция брома с флуоресцеином (получение красителя эозина В)
Растворимость брома в неполярных растворителях выше, поэтому при добавлении толуола к водному раствору, он переходит в органический слой
Щёлочь нейтрализует раствор брома
Реакция смеси сахара и бромата калия с серной кислотой
Предыдущие посты серии:
Бор в гифках
Реакция чистого бора с литием при нагревании смеси
Взрыв смеси декаборана и бертолетовой соли от механического воздействия
Взрыв от реакции декаборана с азотной кислотой
Возгорание в кислороде декоборана, растворённого в сероуглероде
Горение декаборана в жидком кислороде
Реакция тетрагидридобората натрия с тетрахлоридом олова
Реакция тетрагидридобората калия с серной кислотой
Горение борной кислоты в метаноле
Предыдущие посты серии:
Хеллоуин + химия
Фосфор в гифках
Горение белого фосфора с образованием оксида фосфора (V)
Горение красного фосфора (более стабильной модификации элемента)
Кристаллы черного фосфора (форма, в которую переходит элемент при давлении в 20 тысяч атмосфер)
Разрезание ножом стержня из белого фосфора
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу.
(процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего)
Реакция красного фосфора с бромом
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C
Реакция красного фосфора с бертолетовой солью.
Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Чуть больше года назад вёл рубрику с подборками GIF об элементах, но что то потом забиыл.
Думаю стоит всё-таки продолжать начатое 🙂
Предыдущие посты серии:
Буууууум!
________________________________________________________________
Взаимодействие красного фосфора и бертолетовой соли.
Я химик, который по совместительству воспроизводит и разрабатывает различные демонстрационные опыты. Я занимаюсь этим уже очень давно и, наконец, я решил поделиться с вами частичками своей работы. Видео, на которых я что-либо делаю, присылают мне самые разные люди, самых разных возрастов. В связи с этим, они будут разного качества и по разному сняты, прошу, отнеситесь к этому с пониманием!
Эта реакция инициируется простым ударом шпателя, причем детонация происходит с существенной силой и может погнуть шпатель у вас в руках или выбить его из рук:
Если вы находитесь рядом то вам обеспечен звон в ушах после опыта.
Источник видео в моем инстаграме.
Реакция алюминия на ртуть
Очень красивая химическая реакция
Лига химиков, объясните, пожалуйста, что здесь происходит
Говорил я тут недавно с одним знатоком пива по имени @Urobeeros о ТБ и малоадекватных личностях. Между делом я вспомнил один случай из истории человечества, который иллюстрирует теорию Дарвина, причём приспособляемость у человека напрямую связана с кругозором.
Все фото взяты из гугла.
Кругозор расширять никогда не поздно и всегда полезно. Тогда подобных бед можно было бы избежать. Ведь те рабочие тоже могли знать про селитру и аммонал, ведь они же работали в этой компании, могли и нахвататься знаний, если бы было желание, и химики с рабочими общаются, и литература в доступе. Ну или хоть инструкцию ТБ могли запомнить.
Способность металлов к горению на воздухе



| группа | подруппа | Элементы j (*) | Характерные признаки горения на воздухе |
| I | Главная | Щелочные Li, Nа, К, Rb, Cs j |
Нитриды щелочных металлов при 300-350 °С разлагаются на элементы, поэтому в продуктах горения не накапливаются. Нитриды щелочноземельных металлов стабильны до 1500-2000°С, поэтому в реакции горения этих металлов заметно участвует и азот. Более тугоплавкие металлы (B, Аl, Тi, Zr и др.) в порошкообразном виде могут при нагревании воспламеняться и гореть в среде азота с образованием тугоплавких нитридов.
Обобщая рассмотренные данные, можно выделить следующие основные особенности пожарной опасности и горения металлов:
1. Некоторые металлы пирофорны, т.е. способны воспламеняться при контакте с кислородом воздуха, в слитках и массивных изделиях (щелочные), а так же в измельченном, порошкообразном состоянии (железо, никель, кобальт, титан, цирконий и др.).
2. Многие металлы опасно хранить совместно с горючими органическим веществами и материалами. Последние, как правило, легко воспламеняются даже от малокалорийных источников зажигания и могут зажечь металлы, при горении которых развиваются очень высокие температуры (до 3000°С и выше). Достигаемые значения опасных факторов пожара при горении металлов в 1,5-2,0 раза выше, чем при горении других горючих материалов.
3. Следует также отметить большую пожарную опасность многих металлов, способных бурно реагировать с водой со взрывами, интенсивным горением.
Заключительная часть занятия (5 минут):
Преподаватель подводит итоги занятия и доводит задание на самоподготовку. Отмечает курсантов, наиболее активно работавших на занятии. Отвечает на задаваемые вопросы. Подается команда к завершению занятия.
Какую температуру выдерживает холодная сварка в зависимости от марки и особенностей применения?
Холодная сварка применяется во многих случаях при ремонте металлических и неметаллических изделий и деталей. Многие из ремонтируемых с помощью холодной сварки металлических деталей работают при повышенной температуре. Поэтому одной из важных характеристик любой марки является ее максимальная рабочая температура.
Общие условия использования
Характеристики марок холодной сварки, приведенные в их документации, будут выполняться только в том случае, когда соблюдается технология нанесения холодной сварки и основные условия ее применения, которые обычно приведены в инструкции по использованию.
В частности, для соединения двух деталей необходимо:
При применении холодной сварки надо учитывать, что подготовленная масса начинает быстро отвердевать, поэтому работу с составом необходимо производить очень быстро. Если требуется произвести ремонт в большом объеме, то сварку лучше готовить небольшими частями, так как, в противном случае, она затвердеет и не будет годна к работе.
Для улучшения свойств холодной сварки в ее состав вводят наполнитель. Тип такого наполнителя зависит от того материала, на сварку которого рассчитана данная марка. Например, для сварки стали в качестве наполнителя используется железный порошок, а для сварки алюминия – пудра из алюминия. Поэтому для качественного соединения деталей необходимо подбирать соответствующую марку.
Недостатки
К недостаткам холодной сварки необходимо отнести:
Типы холодной сварки по температуре применения
По температуре применения марки холодной сварки можно разделить на два типа – общего назначения и термостойкие.
При ремонте автомобиля часто требуется восстановить структуру металла. Это могут быть трещины, скол, износ из-за трения, раковины. Если восстанавливать металл с помощью обычной сварки, то это потребует демонтажа деталей, наличия сварочного аппарата, соответствующих условий, опыта сварщика. Во многих случаях задачи ремонта решаются с помощью холодной сварки.
Средства холодной сварки общего назначения хотя и являются более универсальными, но они не учитывают температурного режима работы деталей.
В автомобиле существует большое количество систем, работающих при повышенных температурах. Такие температуры присутствуют не только в глушителях и выхлопных коллекторах, но в двигателе, в масляной и охлаждающей системах, системе торможения, а также в некоторых электрических частях автомобиля.

Для рабочих температур свыше + 200 °С в автомобилях рекомендуется применять составы высокотемпературной холодной сварки.
Стойкость к действию температуры
В процессе применения холодной сварки для различных случаев ремонта требуется знание допустимой рабочей температуры этого средства.
Обычные марки сварки имеют максимальную температуру порядка +(260…275) °С. Для специальных случаев промышленность выпускает термостойкую сварку, допустимая температура которой достигает + 900°С и даже +1316 °С.
В таблице приведены максимальные температуры для некоторых видов и особенности их характеристик.
| Марка | Температура, °С | Особенности |
| Permatex (США) | +146 | Стойкая к агрессивной среде |
| ABRO (США) | +260 | Универсальная |
| Hi-gear (США) | +260 | Универсальная |
| Титан (Россия) | +160 | Высокие характеристики |
| Момент (Россия) | +140 | Стойкость к касательной нагрузке |
| Термо (Россия) | +900 | Термостойкая |
| Алмаз (Россия) | +1316 | Термостойкая |
Для увеличения рабочей температуры в состав добавляются различные добавки.
Например, термостойкая сварка «Термо» в своем составе содержит металлосиликатную композицию с повышенной вязкостью. С помощью марки такого состава, армированного стекловолокном, можно устранять дефекты (трещины, сколы) на деталях из стали, чугуна, титана и других жаропрочных сплавов, а также на керамике и теплоизоляционных материалах. Такая сварка может быть использована для ремонта без демонтажа прогоревших глушителей и систем выпуска газа автомобиля. Кроме высокой термостойкости, сварка «Термо» может выдерживать вибрации и механические нагрузки.