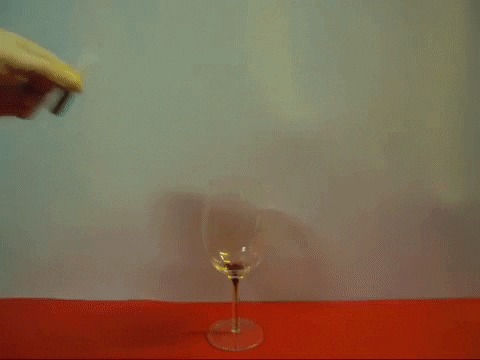какой металл шипит в воде
Какой металл шипит в воде

Эксперимент проводил коллега Юнгвирта Филип Мейсон (Philip Mason). Он учёл, что натрий иногда (например, при неправильном хранении) может окислиться на поверхности и не взорваться, и чтобы получить желаемую реакцию, использовал в своём опыте сплав натрия и калия. Сплав представляет собой жидкость при комнатной температуре.
Мейсон капнул сплав в стакан с водой и заснял весь процесс на высокоскоростную камеру. Затем учёные, наконец, вычислили, что именно провоцирует бурную реакцию на ранних стадиях.
Реакция начинается меньше чем через миллисекунду после того, как металлическая капля, выпущенная из шприца, соприкасается с водой. Спустя всего 0,4 миллисекунды металл начинает выстреливать «шипами», и происходит это слишком быстро, чтобы быть вызванным одним лишь теплом, делают вывод учёные.
Более того, между 0,3 и 0,5 миллисекундами вокруг металлических шипов в жидкости образуются сине-фиолетовые облака. Ранее подобного химики не замечали.
Исследователи провели квантово-механическое компьютерное моделирование процесса с условием, что в реакции было задействовано всего 19 атомов натрия. Исследователи обнаружили, что каждый из атомов на поверхности металла теряет электрон в течение всего нескольких пикосекунд, и что эти электроны «выстреливают» в окружающую воду, где они окружаются молекулами воды.
Сольватированные электроны, как уже известно, имеют глубокий синий цвет, что непродолжительное время и наблюдается на видеозаписи.
Исследование опубликовано в Nature Chemistry
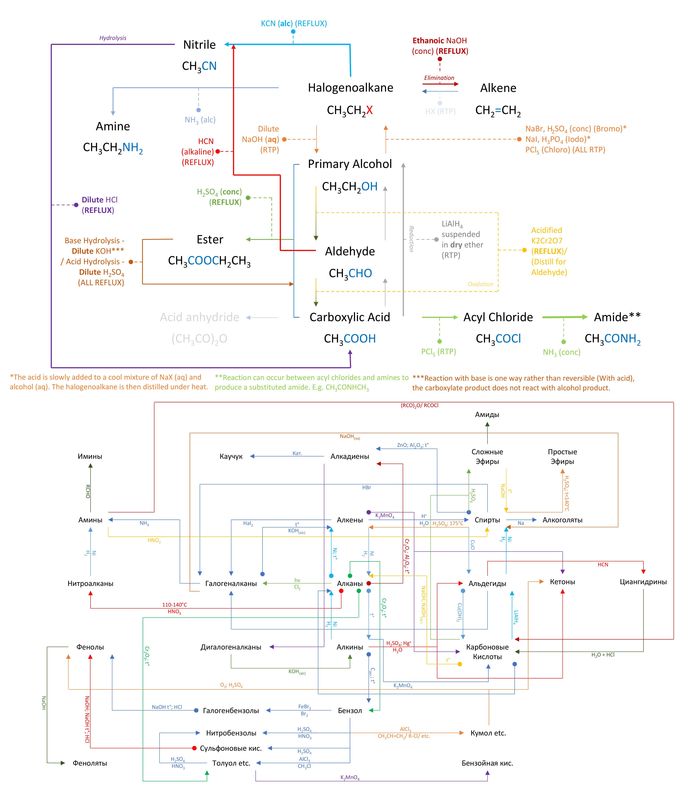
Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 о С). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
Теперь понятно почему его звали Кальцифер
совершенно невинный вопрос: а в бензине он тоже воспламеняется?)
было бы шикарно запустить лепёшку калия по воде =D
Вулкан Бёттгера. Эксперимент. (запись №6)
Окислителем является хром ( VI ), который в результате реакции превращается в хром ( III ). В результате этого образуется зеленый оксид хрома.
(NH4)2Cr2O7 = N2 + 4H2O + Cr2 O 3
Ученый решил провести опыты по способности вещества взрываться от удара и загораться от лучины. При ударе кристаллы дихромата аммония превратились в порошок.
После чего ученый поднес к горке порошка горящую лучину. Возгорания не произошло, но вокруг лучинки начали подпрыгивать раскаленные частицы вещества, а горка начала увеличиваться.
Также изменился ее цвет, он стал зеленым.
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) и при взаимодействии с водой.
Дихромат аммония до термической реакции (фото из интернета, не мое)
Хлорка и антифриз (не повторять. )
Решили мы набрать хлорки в бутылку, в бутылке оставалось немного антифриза, пошла реакция. Ну как же не попробовать бахнуть
Переозвучивает сам. Произношение настолько плохое, что это даже хорошо, ибо народ кайфует с его русского акцента.
Про оговорку во фразе This results in beautiful hedgehog.
В качестве достоинств иностранный зритель отмечает, что тут есть настоящие эксперименты над теми веществами, о которых в ролике идёт речь.
Для примера видео про олово, от которого я узнал про существование второго канала.
Обычно это вещество используется в качестве сельскохозяйственного удобрения.
Однако, чтобы произошла катастрофа, подобная взрыву в Бейруте, многое должно было пойти не так. К сожалению, именно это и случилось в ливанской столице.
Сам по себе нитрат аммония не горит. Вместо этого, он действует как источник кислорода, который может ускорить горение других материалов.
Взрыв аммиачной селитры производит огромное количество оксидов азота. Диоксид азота (NO₂) — красный газ с неприятным запахом. Ролики из Бейрута показывают отчетливый красноватый цвет шлейфа газов от взрыва.
Джеффри Льюис, эксперт по ядерному оружию из Института международных исследований Миддлбери в Калифорнии, оценил мощность взрыва в Бейруте «от 200 до 500 тонн в тротиловом эквиваленте, учитывая ущерб от взрыва, ударную волну, сейсмические сигналы и размер воронки».
Разница в цепочках реакций по химии между Великобританским A-level и Русским ЕГЭ (Обе программы сдаются в 18 лет)
Иод в гифках
Если ёмкость с газообразным иодом накрыть охлаждённой колбой, то кристаллы будут формироваться прямо на её стенке
Существует заблуждение, что у иода нет в принципе жидкого агрегатного состояния, однако его можно получить, если в пробирке с веществом поддерживать температуру между 114°C и 184°C
(или же нагревать иод в условиях повышенного давления)
Реакция иода с металлическим рубидием
Иод растворяется в воде плохо, но хорошо в неполярных растворителях (например в циклогексане)
Образование иодоформа при добавлении гидроксида натрия к спиртовой настойке йода
Термическое разложение пентаоксида дииода
Реакция порошка алюминия с пентаоксидом дииода при нагревании
Взрыв нитрида трииода от механического воздействия
Реакция трихлорида иода с декабораном
Смесь перекиси водорода и серной кислоты добавляют к смеси иодида калия, тиосульфата натрия и крахмала. Происходят реакции окисления иодида до иода и одновременное его же восстановления тиосульфатом обратно до иодида. Как только тиосульфат заканчивается и иодид перестает образовываться, раствор мгновенно темнеет из-за получившегося комплекса с крахмалом.
Предыдущие посты серии:
P.S. Элемент называется именно иод (иодиды, иодоводород, иодная к-та и пр.)
Учительница года
Бром в гифках
Реакция брома с алюминием
Реакция брома с металлическим натрием
Реакция брома с красным фосфором
Реакция брома с кремнием
Реакция брома с флуоресцеином (получение красителя эозина В)
Растворимость брома в неполярных растворителях выше, поэтому при добавлении толуола к водному раствору, он переходит в органический слой
Щёлочь нейтрализует раствор брома
Реакция смеси сахара и бромата калия с серной кислотой
Предыдущие посты серии:
Бор в гифках
Реакция чистого бора с литием при нагревании смеси
Взрыв смеси декаборана и бертолетовой соли от механического воздействия
Взрыв от реакции декаборана с азотной кислотой
Возгорание в кислороде декоборана, растворённого в сероуглероде
Горение декаборана в жидком кислороде
Реакция тетрагидридобората натрия с тетрахлоридом олова
Реакция тетрагидридобората калия с серной кислотой
Горение борной кислоты в метаноле
Предыдущие посты серии:
Хеллоуин + химия
Фосфор в гифках
Горение белого фосфора с образованием оксида фосфора (V)
Горение красного фосфора (более стабильной модификации элемента)
Кристаллы черного фосфора (форма, в которую переходит элемент при давлении в 20 тысяч атмосфер)
Разрезание ножом стержня из белого фосфора
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу.
(процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего)
Реакция красного фосфора с бромом
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C
Реакция красного фосфора с бертолетовой солью.
Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Чуть больше года назад вёл рубрику с подборками GIF об элементах, но что то потом забиыл.
Думаю стоит всё-таки продолжать начатое 🙂
Предыдущие посты серии:
Буууууум!
________________________________________________________________
Взаимодействие красного фосфора и бертолетовой соли.
Я химик, который по совместительству воспроизводит и разрабатывает различные демонстрационные опыты. Я занимаюсь этим уже очень давно и, наконец, я решил поделиться с вами частичками своей работы. Видео, на которых я что-либо делаю, присылают мне самые разные люди, самых разных возрастов. В связи с этим, они будут разного качества и по разному сняты, прошу, отнеситесь к этому с пониманием!
Эта реакция инициируется простым ударом шпателя, причем детонация происходит с существенной силой и может погнуть шпатель у вас в руках или выбить его из рук:
Если вы находитесь рядом то вам обеспечен звон в ушах после опыта.
Источник видео в моем инстаграме.
Реакция алюминия на ртуть
Очень красивая химическая реакция
Лига химиков, объясните, пожалуйста, что здесь происходит
Говорил я тут недавно с одним знатоком пива по имени @Urobeeros о ТБ и малоадекватных личностях. Между делом я вспомнил один случай из истории человечества, который иллюстрирует теорию Дарвина, причём приспособляемость у человека напрямую связана с кругозором.
Все фото взяты из гугла.
Кругозор расширять никогда не поздно и всегда полезно. Тогда подобных бед можно было бы избежать. Ведь те рабочие тоже могли знать про селитру и аммонал, ведь они же работали в этой компании, могли и нахвататься знаний, если бы было желание, и химики с рабочими общаются, и литература в доступе. Ну или хоть инструкцию ТБ могли запомнить.
Какой металл взрывается в воде
Мир полон необычного, и герой этой статьи — яркое тому подтверждение. Это металл настолько мягкий, что его можно резать ножом, словно сливочное масло. В чистом виде он представляет собой серое вещество с легким блеском, температура его плавления — около 80ºC. Как металл он был открыт относительно недавно, в начале XVIII в., хотя всегда присутствовал в жизни человека. Мы ежедневно употребляем соединения этого металла в пищу, а еще он содержится в составе крови и участвует в минеральном обмене всех живых организмов.
Речь идет о натрии, а соединение металла, которое мы ежедневно употребляем в пищу, — это хлористый натрий или просто пищевая соль.
В природе натрия существует более, чем достаточно. Примерное его содержание в толще земной коры составляет 3 %, и никаких трудностей, связанных с его добычей, не возникает.
Активный элемент
Этот металл является очень активным веществом и в процессе ряда химических реакций выделяет большое количество тепла, может воспламениться, а также взлететь на воздух. Например, если положить небольшой кусочек чистого натрия в воду, начнется химическая реакция, в процессе которой выделится газообразный водород, легко взрывающийся. Причем чем больше кусок металла, контактирующего с водой, тем более велика вероятность мощнейшего взрыва. При горении натрия выделяется ряд веществ, обладающих сильным разъедающим действием, поэтому такой эксперимент нельзя проводить самостоятельно без применения специального оборудования, иначе это грозит серьезными последствиями для организма человека.
Где используется натрий? Металл и его соединения применяются буквально везде, начиная с ядерной физики и заканчивая пищевой промышленностью.
В чистом виде вещество употребляют в качестве теплоносителя, восстановителя и катализатора в ряде химический реакций.
Гидроксид натрия
Его широко используют практически во всех видах промышленности, включая химическую, а также бумажную и текстильную. Это соединение активно используется в такой отрасли, как мыловарение.
Пероксид натрия
Используют для обесцвечивания различных текстильных материалов, включая шерсть, хлопок и шелк.
Кальцинированная и пищевая соды тоже являются продуктами соединения натрия.
Бромид натрия
Нашел широкое применение в медицине, его используют как компонент многих лекарственных препаратов.
Нитрат натрия
Является азотным удобрением, который позволяет повысить количество урожая.
Хлорид натрия
Обыкновенная поваренная соль массово используется в пищевой промышленности, находится в составе практически всех продуктов, изготавливаемых на данный момент.
Силикат натрия
С его помощью получают растворимое стекло, широко применяемое на всех этапах строительства.
Фторид натрия
Активно используют в деревообрабатывающей промышленности.
В настоящее время цена натрия на мировом рынке достаточно низкая, что обусловлено его повсеместным присутствием в естественной среде. В год человечеством употребляется более 100 млн т этого вещества, причем с каждым годом эта цифра возрастает.
Ржавчина и коррозия-4: как ржавеет гвоздь в разных условиях
Что это значит? Что весной свойства воды отличаются от свойств воды летом?
Для доказательства этого факта придется ставить многолетний опыт. посмотрим, хватит ли у меня энтузиазма. однако я точно ничего не читала в химических книгах о коррозии о различиях в зависимости от сезона, хотя где-то читала о том, что весенний бетон отличается от осеннего.
Теперь коррозия в разных условиях:
Дистиллированная вода + гвоздь + масло сверху (чтобы изолировать от проникновения воздуха)
Июньский опыт:
Июльский опыт:
Дистиллированная вода + гвоздь + резиновая пробка (для предотвращения поступления дополнительного воздуха извне)
Июньский опыт:
Июльский опыт:
Дистиллированная вода + гвоздь (свободное поступление воздуха)
Июньский опыт:
Июльский опыт:
Водопроводная вода + гвоздь (свободное поступление воздуха)
Июньский опыт:
Июльский опыт:
Водопроводная вода + гвоздь + постоянный магнит (как влияет магнитное поле на коррозию)
Июньский опыт:
Июльский опыт:
Дистиллированная вода + гвоздь + NaCl, насыпанная на дно (как соль влияет на скорость коррозии)
Июньский опыт:
Июльский опыт:
Водопроводная вода + гвоздь + NaCl, насыпанная на дно (чуть меньше соли получилось в июльском опыте)
Июньский опыт:
Июльский опыт:
Водопроводная вода + гвоздь + медь (медь должна усиливать коррозию железа)
Июньский опыт:
Водопроводная вода + гвоздь + H2SO4 (кислота должна ускорять коррозию)
Июньский опыт:
Июльский опыт:
Исходя из обычных представлений о коррозии железа, ожидалось, что под маслом и под резиновой пробкой коррозия гвоздя должна быть замедленной или вообще отсутствовать, поскольку нет возможности для воздуха проникать в воду. Однако видно, что коррозия прекрасно себе идет и под маслом, и под резиновой пробкой, ну, может, чуть медленнее, чем в открытой пробирке. Неужели проникновение воздуха в раствор не играет роли?
Кроме того, в открытой пробирке образуется больше хлопьев, падающих на дно, а в пробирке с маслом образуется пылевидный налет по стенкам пробирки вместо хлопьев. Выходит, масло как-то препятствует образованию хлопьев?
При сравнении коррозии в дистиллированной воде и водопроводной видно, что черные колечки в дистиллированной воде начинают образовываться уже к 8 суткам, а в водопроводной только после 20 суток. Что же это за черное вещество? Это может быть FeO или Fe3O4, а может и углерод, хотя в стали углерода не более 1,2%. Обожгла гвоздь с налетом на газу, если бы это был углерод, он бы превратился в СО2 и улетучился, вместо этого черный налет приобрел бурый оттенок. Выходит, это все-таки FeO, который при обжиге превращается в Fe2O3?
А дистиллированная вода быстрее реагирует с гвоздем, чем водопроводная, это видно и по скорости образования осадка на дне пробирки, и по скорости превращения Fe2O3 (оранжевого) в Fe3O4 (черный).
NaCl замедляет процесс коррозии. Чем больше было соли, тем медленнее ржавел гвоздь. Хотя
считается, что, напротив, соль ускоряет коррозию, потому что в море любое железо разрушается быстрее.