какой металл относится к щелочным металлам
Щелочные металлы
Щелочные металлы.
К щелочным металлам относятся литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Щелочные металлы:
Щелочные металлы – это химические элементы 1-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации – элементы главной подгруппы I группы):
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Строение атомов щелочных металлов:
Радиус атома лития составляет 145 пм. Потенциал ионизации (первый электрон) атома лития равен 5,39 эВ (519,9 кДж/моль). Электроотрицательность атома лития равна 0,98 (шкала Полинга).
Радиус атома натрия составляет 190 пм. Потенциал ионизации атома натрия равен 5,14 эВ (495,6 кДж/моль). Электроотрицательность атома натрия равна 0,93 (шкала Полинга).
Радиус атома калия составляет 235 пм. Потенциал ионизации атома калия равен 4,34 эВ (418,5 кДж/моль). Электроотрицательность атома калия равна 0,82 (шкала Полинга).
Радиус атома рубидия составляет 248 пм. Потенциал ионизации атома рубидия равен 4,17 эВ (402,8 кДж/моль). Электроотрицательность атома рубидия равна 0,82 (шкала Полинга).
Радиус атома цезия составляет 267 пм. Потенциал ионизации атома цезия равен 3,89 эВ (375,5 кДж/моль). Электроотрицательность атома цезия равна 0,79 (шкала Полинга).
С увеличением порядкового номера у щелочных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Физические свойства щелочных металлов:
С увеличением порядкового номера у щелочных металлов уменьшаются плотность, температура плавления, температура кипения, твердость.
Химические свойства щелочных металлов:
Все щелочные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями. Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. В соединениях щелочные металлы проявляют единственную степень окисления +1. Все соединения щелочных металлов носят ионный характер. Почти все соединения растворимы в воде.
С увеличением порядкового номера у щелочных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность их щелочей.
Какой металл относится к щелочным металлам
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.
Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
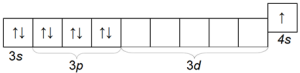
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns 1 , где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см 3 ), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
Элемент
Окраска пламени
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид:
При сгорании натрия обычно образуется пероксид (Na2O2):
Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:
Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом:
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.
Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода:
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):
Щелочные металлы находят широкое применение в промышленности и в технике:
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
Щелочные металлы – список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.
Что представляют собой
Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:

Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
Окраска пламени щелочными металлами и их соединениями:
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
Взрывом заканчивается реакция с кислотами.
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Как опознать щелочной металл
Вид щелочного металла «выдает» окрас пламени:
Натрий либо его соединения делают пламя охристо-желтым.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Щелочные металлы
В группу щелочных металлов входит следующий ряд металлов; литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr. Они находятся в главной подгруппе I группы периодической системы.
Все эти металлы сходны в том отношении, что на внешнем электронном слое их имеется один электрон (табл. 18)/.
Щелочные металлы относятся к числу s-элементов. Электрон внешнего электронного слоя атома щелочного металла по сравнению с другими элементами того же периода наиболее удален от ядра, т. е. радиус атома щелочного металла наибольший по сравнению с радиусами атомов других элементов того же периода. В связи




















 Рис. 76. Схема установки для электролиза расплава поваренной соли. 1 — кольцевой катод; 2 — колокол для выведения газообразного хлора из анодного пространства
Рис. 76. Схема установки для электролиза расплава поваренной соли. 1 — кольцевой катод; 2 — колокол для выведения газообразного хлора из анодного пространства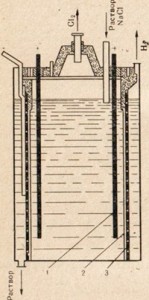 Рис. 77. Схема установки для электролиза раствора поваренной соли. 1 — анод; 2 — диафрагма, разделяющее анодное и катодное пространство; 3 —катод
Рис. 77. Схема установки для электролиза раствора поваренной соли. 1 — анод; 2 — диафрагма, разделяющее анодное и катодное пространство; 3 —катод Рис. 78. Применение едкого натра
Рис. 78. Применение едкого натра