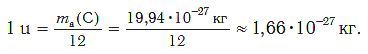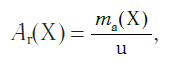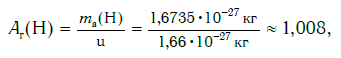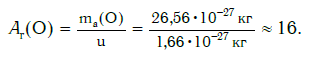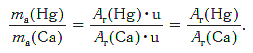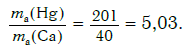какой металл обладает наименьшей атомной массой
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
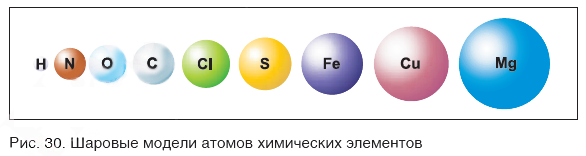
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
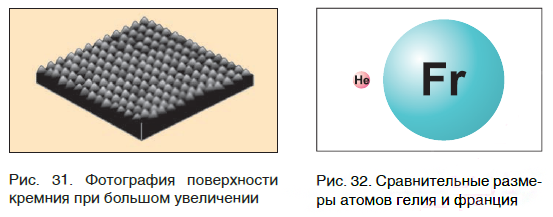
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Таблица атомных масс
Таблица атомных масс химических элементов является частным случаем представления периодической системы Менделеева и применяется для теоретических расчетов в прикладной химии.
| Химический элемент | Символ | Атомная масса |
| Водород | H | 1,00794 |
| Гелий | He | 4,002602 |
| Литий | Li | 6,941 |
| Бериллий | Be | 9,012182 |
| Бор | B | 10,811 |
| Углерод | C | 12,0107 |
| Азот | N | 14,0067 |
| Кислород | O | 15,9994 |
| Фтор | F | 18,9984032 |
| Неон | Ne | 20,1797 |
| Натрий | Na | 22,98976928 |
| Магний | Mg | 24,3050 |
| Алюминий | Al | 26,9815386 |
| Кремний | Si | 28,0855 |
| Фосфор | P | 30,973762 |
| Сера | S | 32,065 |
| Хлор | Cl | 35,453 |
| Аргон | Ar | 39,948 |
| Калий | K | 39,0983 |
| Кальций | Ca | 40,078 |
| Скандий | Sc | 44,955912 |
| Титан | Ti | 47,867 |
| Ванадий | V | 50,9415 |
| Хром | Cr | 51,9961 |
| Марганец | Mn | 54,938045 |
| Железо | Fe | 55,845 |
| Кобальт | Co | 58,933195 |
| Никель | Ni | 58,6934 |
| Медь | Cu | 63,546 |
| Цинк | Zn | 65,409 |
| Галлий | Ga | 69,723 |
| Германий | Ge | 72,64 |
| Мышьяк | As | 74,92160 |
| Селен | Se | 78,96 |
| Бром | Br | 79,904 |
| Криптон | Kr | 83,798 |
| Рубидий | Rb | 85,4678 |
| Стронций | Sr | 87,62 |
| Иттрий | Y | 88,90585 |
| Цирконий | Zr | 91,224 |
| Ниобий | Nb | 92,90638 |
| Молибден | Mo | 95,94 |
| Технеций | Tc | 98,9063 |
| Рутений | Ru | 101,07 |
| Родий | Rh | 102,90550 |
| Палладий | Pd | 106,42 |
| Серебро | Ag | 107,8682 |
| Кадмий | Cd | 112,411 |
| Индий | In | 114,818 |
| Олово | Sn | 118,710 |
| Сурьма | Sb | 121,760 |
| Теллур | Te | 127,60 |
| Иод | I | 126,90447 |
| Ксенон | Xe | 131,293 |
| Цезий | Cs | 132,9054519 |
| Барий | Ba | 137,327 |
| Лантан | La | 138,90547 |
| Церий | Ce | 140,116 |
| Празеодим | Pr | 140,90765 |
| Неодим | Nd | 144,242 |
| Прометий | Pm | 146,9151 |
| Самарий | Sm | 150,36 |
| Европий | Eu | 151,964 |
| Гадолиний | Gd | 157,25 |
| Тербий | Tb | 158,92535 |
| Диспрозий | Dy | 162,500 |
| Гольмий | Ho | 164,93032 |
| Эрбий | Er | 167,259 |
| Тулий | Tm | 168,93421 |
| Иттербий | Yb | 173,04 |
| Лютеций | Lu | 174,967 |
| Гафний | Hf | 178,49 |
| Тантал | Ta | 180,9479 |
| Вольфрам | W | 183,84 |
| Рений | Re | 186,207 |
| Осмий | Os | 190,23 |
| Иридий | Ir | 192,217 |
| Платина | Pt | 195,084 |
| Золото | Au | 196,966569 |
| Ртуть | Hg | 200,59 |
| Таллий | Tl | 204,3833 |
| Свинец | Pb | 207,2 |
| Висмут | Bi | 208,98040 |
| Полоний | Po | 208,9824 |
| Астат | At | 209,9871 |
| Радон | Rn | 222,0176 |
| Франций | Fr | 223,0197 |
| Радий | Ra | 226,0254 |
| Актиний | Ac | 227,0278 |
| Торий | Th | 232,03806 |
| Протактиний | Pa | 231,03588 |
| Уран | U | 238,02891 |
| Нептуний | Np | 237,0482 |
| Плутоний | Pu | 244,0642 |
| Америций | Am | 243,0614 |
| Кюрий | Cm | 247,0703 |
| Берклий | Bk | 247,0703 |
| Калифорний | Cf | 251,0796 |
| Эйнштейний | Es | 252,0829 |
| Фермий | Fm | 257,0951 |
| Менделевий | Md | 258,0986 |
| Нобелий | No | 259,1009 |
| Лоуренсий | Lr | 266 |
| Резерфордий | Rf | 267 |
| Дубний | Db | 268 |
| Сиборгий | Sg | 269 |
| Борий | Bh | 270 |
| Хассий | Hs | 277 |
| Мейтнерий | Mt | 278 |
| Дармштадтий | Ds | 281 |
| Рентгений | Rg | 282 |
| Коперниций | Cn | 285 |
| Нихоний | Nh | 286 |
| Флеровий | Fl | 289 |
| Московий | Mc | 290 |
| Ливерморий | Lv | 293 |
| Теннессин | Ts | 294 |
| Оганесон | Og | 294 |
На этой странице представлена таблица химических элементов, упорядоченная в порядке возрастания их атомных номеров.
§ 1.3. Размеры атомов разных химических элементов, их абсолютные и относительные массы
Мы уже знаем, что атомы химических элементов могут отличаться друг от друга по составу и, очевидно, что это должно влиять на их массу, поскольку чем больше в ядре атома суммарное количество протонов и нейтронов, тем он тяжелее. Электроны практически не влияют на массу атома, поскольку обладают крайне малой по сравнению с нейтронами и протонами массой (mp/me
Так как количество протонов в каждом атоме всегда равно количеству электронов, а электроны, если рассматривать строение атома упрощенно, движутся вокруг ядра на значительном от него удалении, то радиус атома равен радиусу орбиты наиболее удаленного от ядра электрона. Следовательно, должна быть некоторая зависимость радиуса атома от количества таких орбит, которая в какой-то степени связана с количеством электронов.
99 %). Одну двенадцатую массы атома данного изотопа углерода было принято обозначать 1 а.е.м., что расшифровывается как «атомная единица массы». Одна атомная единица массы равно примерно 1,66·10 −27 кг.
Графическое представление смысла одной атомной единицы массы представлено на рисунке 2.

Таким образом, мы подошли к определению нового термина – относительной атомной массы:
Определение: относительная атомная масса химического элемента равна отношению его абсолютной массы к одной двенадцатой абсолютной массы атома углерода или к массе одной атомной единицы массы.
Относительную атомную массу обозначают символом Ar (индекс r означает сокращение от английского слова relative, что переводится как «относительный»). Таким образом, обозначив в общем виде химический элемент символом Х, мы получаем следующую формульную запись представленного выше определения:
Относительная атомная масса — величина безразмерная, так как в числителе и знаменателе находятся значения, измеряемые в одинаковых единицах массы (кг, г или др.). Согласно представленной выше формуле, например, относительная атомная масса водорода равна:
а относительная атомная масса кислорода:
В большинстве расчетных задач, с которыми приходится иметь дело химикам, используются значения относительных атомных масс, округленные до целочисленных значений, т.е. применительно к водороду и кислороду:
Следует отметить, что атомную массу хлора округляют до 35,5. Это связано с тем, что у данного элемента наиболее распространенные в природе изотопы имеют относительные атомные массы 35 и 37, а их содержание в смеси близко к 3:1 в пользу более легкого.
Список элементов по атомной массе
Это список химических элементов отсортированных по относительной атомной массе, с наиболее стабильными изотопами для искусственно полученных элементов. Цветом закодирован тип элемента. В таблице приведены атомный номер, название, символ химического элемента, а также группа и период элементов. Число в круглых скобках даёт неопределённость в последних цифрах (см. «краткое примечание» на IUPAC). Например, 1.00794 (7) означает 1.00794 ± 0.00007. Для искусственных элементов атомная масса приводится для наиболее устойчивого изотопа в квадратных скобках.
| Щелочные металлы | Щелочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Благородные газы |
| Атомный номер | Название | Символ | Относительная атомная масса | Группа | Период |
|---|---|---|---|---|---|
| 1 | Водород | H | 0001.00794 1.00794(7) [1] [2] [3] | 1 | 1 |
| 2 | Гелий | He | 0004.002602 4.002602(2) [1] [3] | 18 | 1 |
| 3 | Литий | Li | 0006.941 6.941(2) [1] [2] [3] [4] | 1 | 2 |
| 4 | Бериллий | Be | 0009.012182 9.012182(3) | 2 | 2 |
| 5 | Бор (элемент) | B | 0010.811 10.811(7) [1] [2] [3] | 13 | 2 |
| 6 | Углерод | C | 0012.0107 12.0107(8) [1] [3] | 14 | 2 |
| 7 | Азот | N | 0014.0067 14.0067(2) [1] [3] | 15 | 2 |
| 8 | Кислород | O | 0015.9994 15.9994(3) [1] [3] | 16 | 2 |
| 9 | Фтор | F | 0018.9984032 18.9984032(5) | 17 | 2 |
| 10 | Неон | Ne | 0020.1797 20.1797(6) [1] [2] | 18 | 2 |
| 11 | Натрий | Na | 0022.98976928 22.98976928(2) | 1 | 3 |
| 12 | Магний | Mg | 0024.3050 24.3050(6) | 2 | 3 |
| 13 | Алюминий | Al | 0026.9815386 26.9815386(8) | 13 | 3 |
| 14 | Кремний | Si | 0028.0855 28.0855(3) [3] | 14 | 3 |
| 15 | Фосфор | P | 0030.973762 30.973762(2) | 15 | 3 |
| 16 | Сера | S | 0032.065 32.065(5) [1] [3] | 16 | 3 |
| 17 | Хлор | Cl | 0035.453 35.453(2) [1] [2] [3] | 17 | 3 |
| 19 | Калий | K | 0039.0983 39.0983(1) | 1 | 4 |
| 18 | Аргон | Ar | 0039.948 39.948(1) [1] [3] | 18 | 3 |
| 20 | Кальций | Ca | 0040.078 40.078(4) [1] | 2 | 4 |
| 21 | Скандий | Sc | 0044.955912 44.955912(6) | 3 | 4 |
| 22 | Титан | Ti | 0047.867 47.867(1) | 4 | 4 |
| 23 | Ванадий | V | 0050.9415 50.9415(1) | 5 | 4 |
| 24 | Хром | Cr | 0051.9961 51.9961(6) | 6 | 4 |
| 25 | Марганец | Mn | 0054.938045 54.938045(5) | 7 | 4 |
| 26 | Железо | Fe | 0055.845 55.845(2) | 8 | 4 |
| 28 | Никель | Ni | 0058.6934 58.6934(2) | 10 | 4 |
| 27 | Кобальт | Co | 0058.933195 58.933195(5) | 9 | 4 |
| 29 | Медь | Cu | 0063.546 63.546(3) [3] | 11 | 4 |
| 30 | Цинк | Zn | 0065.409 65.409(4) | 12 | 4 |
| 31 | Галлий | Ga | 0069.723 69.723(1) | 13 | 4 |
| 32 | Германий | Ge | 0072.64 72.64(1) | 14 | 4 |
| 33 | Мышьяк | As | 0074.92160 74.92160(2) | 15 | 4 |
| 34 | Селен | Se | 0078.96 78.96(3) [3] | 16 | 4 |
| 35 | Бром | Br | 0079.904 79.904(1) | 17 | 4 |
| 36 | Криптон | Kr | 0083.798 83.798(2) [1] [2] | 18 | 4 |
| 37 | Рубидий | Rb | 0085.4678 85.4678(3) [1] | 1 | 5 |
| 38 | Стронций | Sr | 0087.62 87.62(1) [1] [3] | 2 | 5 |
| 39 | Иттрий | Y | 0088.90585 88.90585(2) | 3 | 5 |
| 40 | Цирконий | Zr | 0091.224 91.224(2) [1] | 4 | 5 |
| 41 | Ниобий | Nb | 0092.206 92.906 38(2) | 5 | 5 |
| 42 | Молибден | Mo | 0095.94 95.94(2) [1] | 6 | 5 |
| 43 | Технеций | Tc | 0098 [98] [5] | 7 | 5 |
| 44 | Рутений | Ru | 0101.07 101.07(2) [1] | 8 | 5 |
| 45 | Родий | Rh | 0102.905 102.905 50(2) | 9 | 5 |
| 46 | Палладий | Pd | 0106.42 106.42(1) [1] | 10 | 5 |
| 47 | Серебро | Ag | 0107.8682 107.8682(2) [1] | 11 | 5 |
| 48 | Кадмий | Cd | 0112.411 112.411(8) [1] | 12 | 5 |
| 49 | Индий | In | 0114.818 114.818(3) | 13 | 5 |
| 50 | Олово | Sn | 0118.710 118.710(7) [1] | 14 | 5 |
| 51 | Сурьма | Sb | 0121.760 121.760(1) [1] | 15 | 5 |
| 52 | Теллур | Te | 0127.60 127.60(3) [1] | 16 | 5 |
| 53 | Иод | I | 0126.904 126.904 47(3) | 17 | 5 |
| 54 | Ксенон | Xe | 0131.293 131.293(6) [1] [2] | 18 | 5 |
| 55 | Цезий | Cs | 0132.9054519 132.9054519(2) | 1 | 6 |
| 56 | Барий | Ba | 0137.327 137.327(7) | 2 | 6 |
| 57 | Лантан | La | 0138.90547 138.90547(7) [1] | n/a | 6 |
| 58 | Церий | Ce | 0140.116 140.116(1) [1] | n/a | 6 |
| 59 | Празеодим | Pr | 0140.90765 140.90765(2) | n/a | 6 |
| 60 | Неодим | Nd | 0144.242 144.242(3) [1] | n/a | 6 |
| 61 | Прометий | Pm | 0145 [145] [5] | n/a | 6 |
| 62 | Самарий | Sm | 0150.36 150.36(2) [1] | n/a | 6 |
| 63 | Европий | Eu | 0151.964 151.964(1) [1] | n/a | 6 |
| 64 | Гадолиний | Gd | 0157.25 157.25(3) [1] | n/a | 6 |
| 65 | Тербий | Tb | 0158.92535 158.92535(2) | n/a | 6 |
| 66 | Диспрозий | Dy | 0162.500 162.500(1) [1] | n/a | 6 |
| 67 | Гольмий | Ho | 0164.930 164.930 32(2) | n/a | 6 |
| 68 | Эрбий | Er | 0167.259 167.259(3) [1] | n/a | 6 |
| 69 | Тулий | Tm | 0168.93421 168.93421(2) | n/a | 6 |
| 70 | Иттербий | Yb | 0173.04 173.04(3) [1] | n/a | 6 |
| 71 | Лютеций | Lu | 0174.967 174.967(1) [1] | 3 | 6 |
| 72 | Гафний | Hf | 0178.49 178.49(2) | 4 | 6 |
| 73 | Тантал | Ta | 0180.94788 180.94788(2) | 5 | 6 |
| 74 | Вольфрам | W | 0183.84 183.84(1) | 6 | 6 |
| 75 | Рений | Re | 0186.207 186.207(1) | 7 | 6 |
| 76 | Осмий | Os | 0190.23 190.23(3) [1] | 8 | 6 |
| 77 | Иридий | Ir | 0192.217 192.217(3) | 9 | 6 |
| 78 | Платина | Pt | 0185.084 195.084(9) | 10 | 6 |
| 79 | Золото | Au | 0196.966569 196.966569(4) | 11 | 6 |
| 80 | Ртуть | Hg | 0200.59 200.59(2) | 12 | 6 |
| 81 | Таллий | Tl | 0204.3833 204.3833(2) | 13 | 6 |
| 82 | Свинец | Pb | 0207.2 207.2(1) [1] [3] | 14 | 6 |
| 83 | Висмут | Bi | 0208.98040 208.98040(1) | 15 | 6 |
| 84 | Полоний | Po | 0210 [210] [5] | 16 | 6 |
| 85 | Астат | At | 0210 [210] [5] | 17 | 6 |
| 86 | Радон | Rn | 0220 [220] [5] | 18 | 6 |
| 87 | Франций | Fr | 0223 [223] [5] | 1 | 7 |
| 88 | Радий | Ra | 0226 [226] [5] | 2 | 7 |
| 89 | Актиний | Ac | 0227 [227] [5] | n/a | 7 |
| 90 | Торий | Th | 0232.03806 232.03806(2) [5] [1] | n/a | 7 |
| 91 | Протактиний | Pa | 0231.03588 231.03588(2) [5] | n/a | 7 |
| 93 | Нептуний | Np | 0237 [237] [5] | n/a | 7 |
| 92 | Уран | U | 0238.02891 238.02891(3) [5] [1] [2] | n/a | 7 |
| 94 | Плутоний | Pu | 0244 [244] [5] | n/a | 7 |
| 95 | Америций | Am | 0243 [243] [5] | n/a | 7 |
| 96 | Кюрий | Cm | 0247 [247] [5] | n/a | 7 |
| 97 | Берклий | Bk | 0247 [247] [5] | n/a | 7 |
| 98 | Калифорний | Cf | 0251 [251] [5] | n/a | 7 |
| 99 | Эйнштейний | Es | 0252 [252] [5] | n/a | 7 |
| 100 | Фермий | Fm | 0257 [257] [5] | n/a | 7 |
| 101 | Менделевий | Md | 0258 [258] [5] | n/a | 7 |
| 102 | Нобелий | No | 0259 [259] [5] | n/a | 7 |
| 103 | Лоуренсий | Lr | 0262 [262] [5] | 3 | 7 |
| 104 | Резерфордий | Rf | 0261 [261] [5] | 4 | 7 |
| 105 | Дубний | Db | 0262 [262] [5] | 5 | 7 |
| 106 | Сиборгий | Sg | 0266 [266] [5] | 6 | 7 |
| 107 | Борий | Bh | 0264 [264] [5] | 7 | 7 |
| 108 | Хассий | Hs | 0277 [277] [5] | 8 | 7 |
| 109 | Мейтнерий | Mt | 0268 [268] [5] | 9 | 7 |
| 110 | Дармштадтий | Ds | 0271 [271] [5] | 10 | 7 |
| 111 | Рентгений | Rg | 0272 [272] [5] | 11 | 7 |
| 112 | Унунбий | Uub | 0285 [285] [5] | 12 | 7 |
| 113 | Унунтрий | Uut | 0284 [284] [5] | 13 | 7 |
| 114 | Унунквадий | Uuq | 0289 [289] [5] | 14 | 7 |
| 115 | Унунпентий | Uup | 0288 [288] [5] | 15 | 7 |
| 116 | Унунгексий | Uuh | 0292 [292] [5] | 16 | 7 |
| 118 | Унуноктий | Uuo | 0294 [294] [5] | 18 | 7 |
| Щелочные металлы | Щелочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Благородные газы |
Сноски
Ссылки
Полезное
Смотреть что такое «Список элементов по атомной массе» в других словарях:
Данные для химических элементов — Рекомендованные значения для многих свойств элементов, вместе с различными ссылками, собраны на этих страницах. Любые изменения в величинах, стоящих в инфобоксе, должны быть сопоставлены с приведёнными значениями и/или соответственно приведены… … Википедия
Элементы химические — Каждый Э. х. это совокупность Атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Ядро атомное состоит из протонов, число которых равно атомному номеру (См. Атомный номер) элемента, и нейтронов,… … Большая советская энциклопедия
Хронология химии — Хронология науки химии это список различных работ, исследований, идей, изобретений и экспериментов, которые в значительной мере изменили взгляды человечества на строение вещества и материи и процессы происходящие с ними, которые в данный… … Википедия
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
Франция — (France) Французская Республика, физико географическая характеристика Франции, история Французской республики Символика Франции, государственно политическое устройство Франции, вооружённые силы и полиция Франции, деятельность Франции в НАТО,… … Энциклопедия инвестора
Важнейшие открытия в физике — История технологий По периодам и регионам: Неолитическая революция Древние технологии Египта Наука и технологии древней Индии Наука и технологии древнего Китая Технологии Древней Греции Технологии Древнего Рима Технологии исламского мира… … Википедия
Ядерный взрыв — … Википедия
Третий период периодической системы — К третьему периоду периодической системы относятся элементы третьей строки (или третьего периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Четвёртый период периодической системы — К четвёртому периоду периодической системы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических)… … Википедия
СОЮЗ СОВЕТСКИХ СОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИК — (СССР, Союз ССР, Советский Союз) первое в истории социалистич. гос во. Занимает почти шестую часть обитаемой суши земного шара 22 млн. 402,2 тыс. км2. По численности населения 243,9 млн. чел. (на 1 янв. 1971) Сов. Союзу принадлежит 3 е место в… … Советская историческая энциклопедия