какой металл имеет самую низкую температуру плавления
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
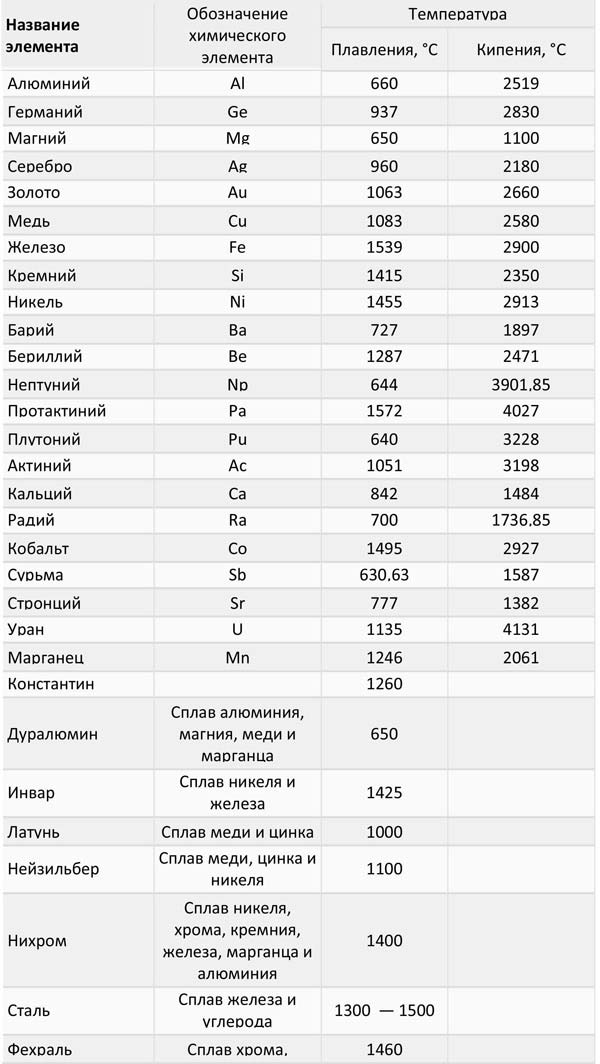
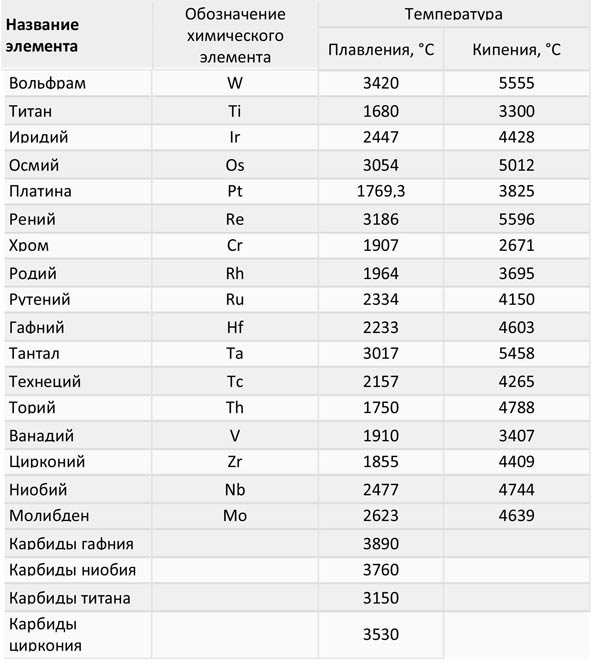
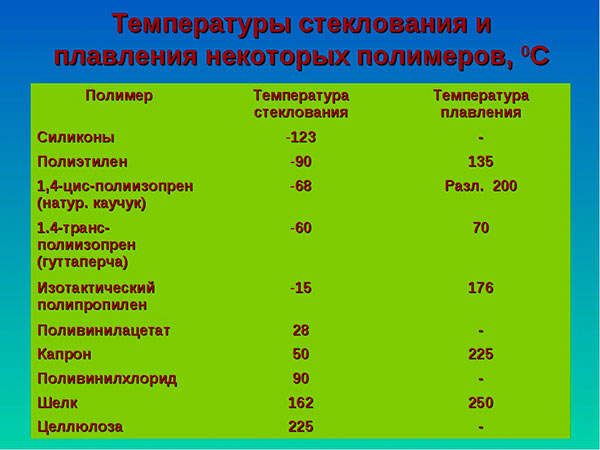
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Температура плавления разных металлов в таблице
Как происходит

При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
Топ-10 металлов с самыми низкими температурами плавления
Однако, твёрдые, прочные и жаростойкие далеко не все металлы. И вещества, такие как натрий, галлий, ртуть — находят необычные применения.
Сегодня, поговорим о десяти металлах с самыми низкими температурами плавления.
10. Олово (231°C)

Химический элемент, занимающий в периодической таблице юбилейное, пятидесятое место известен человечеству с древнейших времён. Первые капли олова (латинское наименование Stannum) первобытные люди заметили в своих кострах ещё за 4 тысячи лет до нашей эры. Немудрено — ведь олово плавится при температуре всего при 231°C. При этом дерево ещё только-только начинает обугливаться и робко гореть.
После застывания «слёзы», которыми плакал в огне красивый тяжёлый камень кассидерит, сохраняли форму, в которой им довелось застыть. Так появились первые металлические предметы кухонного быта.
9. Литий (180°C)

Этот удивительный металл, открыли только в начале XIX века. Литий (Lithium, элемент №3) довольно легкоплавкий — жидкий метал температуры всего 180°C можно помешивать даже деревянной ложечкой.
Литий отличается очень малой плотностью — вдвое легче воды! Металл относится к группе щелочных и довольно активен химически (поэтому его так долго не могли открыть).
В современном мире литий широко используется для создания удивительных сплавов — твёрдых, лёгких и жаропрочных.
Без лития не обходится ни одна современная электронная штучка. Ведь литий является ключевым компонентом компактных и ёмких аккумуляторов. А ещё, именно литий придаёт замечательный алый цвет фейерверкам.
8. Индий (157°C)

В конце XIX века химикам удалось открыть и выделить в чистом виде элемент, занявший в периодической таблице клетку №49. Индий (Indium) — довольно тяжёлый (почти как железо) металл, плавящийся при 157°C.
Этот материал поразительно мягок и пластичен. Мягче этого металла только тальк! Невероятное свойство сделало индий незаменимым в радиоэлектронике. Тонкие индиевые полоски, нанесённые на стекло, хорошо проводят электрический ток — но при этом совершенно прозрачны. Так делают уже привычные нам плоские экраны на основе «жидких кристаллов» (LCD).
7. Натрий (97,8°C)

Натрий (Natrium, 11-й элемент) может расплавиться даже в кипятке — 97,8°C. Но мы бы не советовали позволить даже маленькому кусочку натрия упасть в воду (хотя бы и ледяную). Щелочной металл натрий очень активен химически и немедленно реагирует, отделяя от молекул воды водород и превращаясь в сильнейшую щелочь.
Как очень активный элемент, натрий в том или ином виде присутствует вокруг нас в огромных количествах. Взять хотя бы хлорид натрия — обычная поваренная соль.
6. Калий (63,5°C)

Близкий родственник натрия — калий. Элемент №19 (Kalium) также бурно реагирует с водой, образуя щёлочь, и также легкоплавок — 63,5°C. А вот съедобных соединений калия почти нет, и в этом он полная противоположность натрию. Хотя в ограниченно малых количествах организму всё-таки необходим (микроэлемент).
В чистом виде калий практического применения не имеет. Но его многочисленные соединения с древних времён известны как удобрения, моющие средства, важные компоненты многих химических процессов.
5. Рубидий (39,31°C)

37-й элемент таблицы — рубидий (Rubidium) плавится всего при 39,31°C. Кусочек рубидия может растаять на блюдце как сливочное масло. Это лёгкий металл, его плотность лишь немного превышает плотность воды. Но реагирует с водой рубидий не менее бурно, чем его близкие родственники калий и натрий.
Рубидий удивителен своими химическими свойствами. Сам по себе щелочной металл очень легко вступает в разнообразные химические реакции. Но при этом соли рубидия и его сплавы с другими металлами являются хорошими катализаторами реакций. То есть, значительно ускоряют процесс, при этом совершенно не расходуясь сами по себе. Это делает рубидий ценным материалом для химической промышленности и радиоэлектроники.
4. Цезий (28,5°C)

Очень мягкий серебристый металл буквально плавится в руках. При температуре 28,5°C цезий (Caesium) становится жидкостью и буквально утекает между пальцев. Но не вздумайте провести такой опыт! Из всех щелочных металлов элемент №55 самый химически активный (уступая лишь францию).
На открытом воздухе цезий моментально окисляется, образуя яркое пламя. А при попадании в воду просто взрывается. Цезий ухитряется поджечь даже лёд! Более того, образовавшийся при реакции с водой гидроксид цезия разъедает стекло — и потихоньку грызёт сосуды из золота и даже платины.
А вот в электронике такая активность цезия позволяет делать очень чувствительные фотоэлементы и часы поистине космической точности.
3. Франций (27°C)

Элемент, занимающий 89-ю ячейку периодической таблицы — франций (Francium) — очень похож на цезий. Франций плавится при 27°C, но до этого неимоверно активный щелочной металл ещё требуется сберечь.
Мало того, что франций бурно реагирует буквально со всем подряд — он ещё и очень радиоактивен! Буквально через полчаса от килограмма франция останется — хорошо если горстка — разнообразных сильно излучающих продуктов деления.
Впрочем, в таких количествах его никто никогда и не видел. Неудивительно, что в природе этот элемент один из самых редко встречающихся. Да и практического применения ему так и не нашлось.
2. Галлий (26,79°C)

А вот серебристый металл галлий (Gallium — ещё до открытия элемента Д.И. Менделеев заранее оставил ему в таблице клеточку № 31) встречается гораздо чаще и нередко применяется просто для забав. Плавится он почти как цезий, при 26,79°C, но в остальном разительно отличается от своего «нервного» братца.
Внешне и по механическим свойствам галлий очень похож на алюминий. Лёгок, теплопроводен, в чистом виде довольно хрупок. Мгновенно образующаяся на воздухе плотная плёнка окислов так же хорошо защищает его от разрушения.
В чистом виде галлий практически не находит применения. А вот его соли и, особенно, легкоплавкие сплавы нашли широчайшее применение в ядерной физике, радиоэлектронике, измерительной технике.
1. Ртуть (-38,87°C)

Все мы хорошо знакомы со ртутью — даже сегодня, в век электроники, вряд ли найдётся хоть один человек, которому не измеряли бы температуру тела ртутным термометром. Но мало кто задумывается, что очень текучая тяжёлая серебристая жидкость — самый настоящий металл!
Да-да, элемент №80, Hydrargyrum, плавится на самом лютом морозе — температура кристаллизации ртути почти минус сорок градусов (-38,87°C).
Человечество знакомо со ртутью с древнейших времён. Ртуть находит широчайшее применение в технике, химии, металлургии. Этот элемент достоин отдельного, немаленького рассказа — а сегодня он гордо венчает наш рейтинг.
При каких температурах плавятся различные металлы и неметаллы?
Металлы обладают рядом оригинальных свойств, которые присущи только этим материалам. Существует температура плавления металлов, при которой кристаллическая решетка разрушается. Вещество сохраняет объем, но уже нельзя говорить о постоянстве формы.
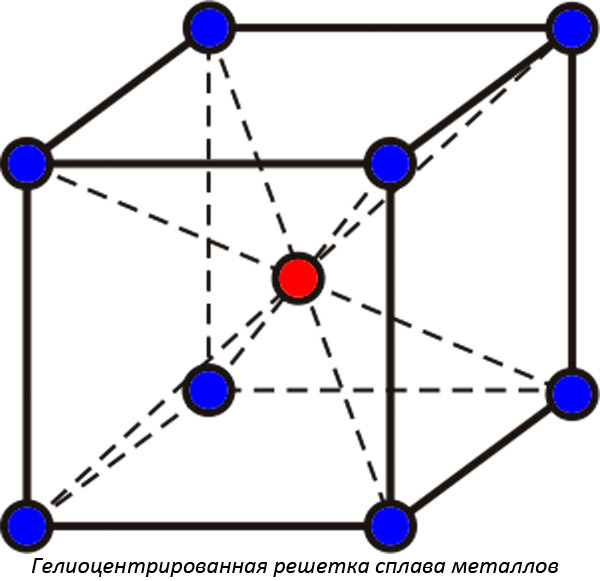
В чистом виде отдельные металлы встречают крайне редко. На практике применяют сплавы. У них есть определенные отличия от чистых веществ. При образовании сложных соединений происходит объединение кристаллических решеток между собой. Поэтому у сплавов свойства могут заметно отличаться от составляющих элементов. Температура плавления уже не остается постоянной величиной, она зависит от концентрации входящих в сплав ингредиентов.
Понятие о шкале температур
Некоторые неметаллические предметы тоже обладают похожими свойствами. Самым распространённым является вода. Относительно свойств жидкости, занимающей господствующее положение на Земле, была разработана шкала температур. Реперными точками признаны температура изменения агрегатных состояний воды:
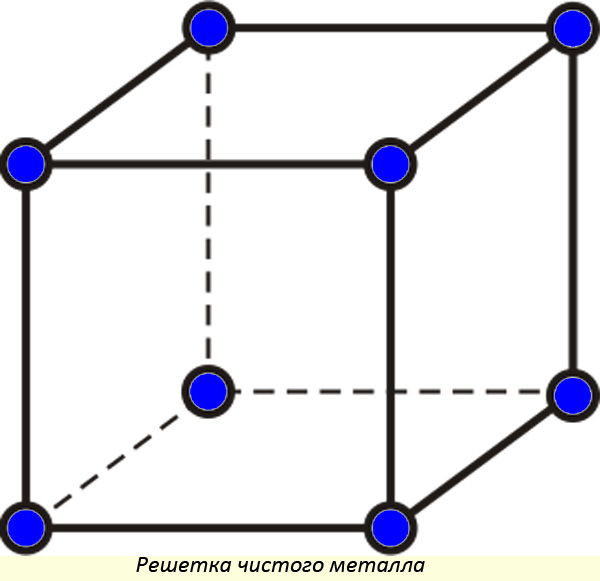
Кристаллические решетки металла
В идеальном виде принято считать, что металлам свойственна кубическая решетка (в реальном веществе могут быть изъяны). Между молекулами имеются равные расстояния по горизонтали и вертикали.
Твердое вещество характеризуется постоянством:
При переходе в жидкое состояние, достигнув определенной температуры, кристаллические решетки разрушаются. Теперь нельзя говорить о постоянстве формы. Жидкость будет принимать ту форму, в какую ее зальют.
Когда происходит испарение, то постоянным остается только масса вещества. Газ займет весь объем, который будет ему предоставлен. Здесь нельзя утверждать, что плотность постоянная величина.
Когда соединяются жидкости, то возможны варианты:
Образующиеся растворимые друг в друге вещества при застывании образуют кристаллические решетки нового типа. Определяют:
Температура плавления металлов
Разные вещества имеют различную температуру плавления. Принято делить металлы на:
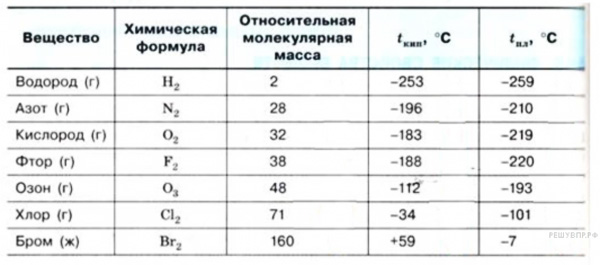
В таблице по возрастанию показаны легкоплавкие металлы. Здесь видно, что самым необычным металлом является ртуть (Hg). В обычных условиях она находится в жидком состоянии. Этот металл имеет самую низкую температуру плавления.
Таблица 1, температуры плавления и кипения легкоплавких металлов:
Таблица 2, температуры плавления и кипения среднеплавких металлов:
Таблица 3, температуры плавления и кипения тугоплавких металлов:
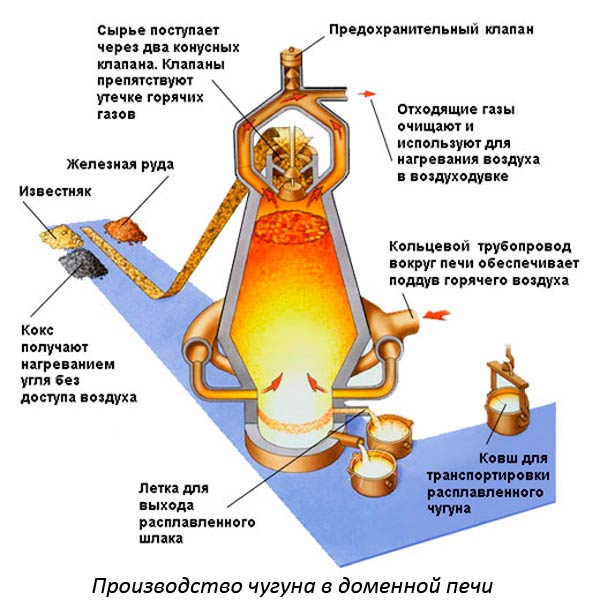
Чтобы вести процесс плавки используют разные устройства. Например, для выплавки чугуна применяют доменные печи. Для плавки цветных металлов производят внутренний нагрев с помощью токов высокой частоты.
В изложницах, изготовленных из неметаллических материалов, находятся цветные металлы в твердом состоянии. Вокруг них создают переменное магнитное поле СВЧ. В результате кристаллические решетки начинают расшатываться. Молекулы вещества приходят в движение, что вызывает разогрев внутри всей массы.
При необходимости плавки небольшого количества легкоплавких металлов используют муфельные печи. В них температура поднимается до 1000…1200 ⁰С, что достаточно для плавки цветных металлов.
Черные металлы расплавляют в конвекторах, мартенах и индукционных печах. Процесс идет с добавлением легирующих компонентов, улучшающих качество металла.
Сложнее всего проводить работу с тугоплавкими металлами. Проблема в том, что нужно использовать материалы, имеющие температуру более высокую, чем температура плавления самого металла. В настоящее время авиационная промышленность рассматривает использование в качестве конструкционного материала Титан (Ti). При высокой скорости полета в атмосфере происходит разогрев обшивки. Поэтому нужна замена алюминию и его сплавам (AL).
Сплавы металлов
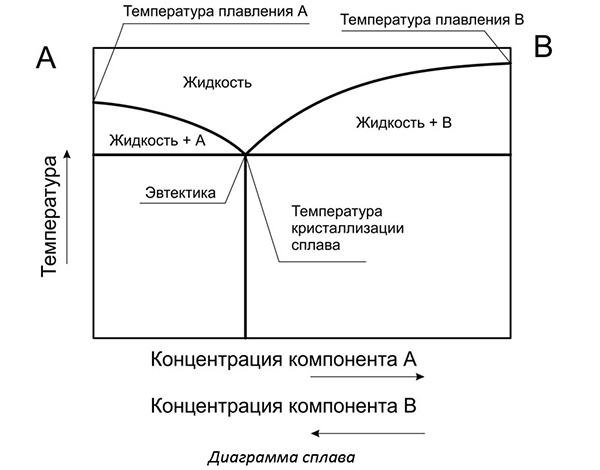
Чтобы проектировать изделия из сплавов, сначала изучают их свойства. Для изучения в небольших емкостях расплавляют изучаемые металлы в разном соотношении между собой. По итогам строят графики.
Нижняя ось представляет концентрацию компонента А с компонентом В. По вертикали рассматривают температуру. Здесь отмечают значения максимальной температуры, когда весь металл находится в расплавленном состоянии.
При охлаждении один из компонентов начинает образовывать кристаллы. В жидком состоянии находится эвтектика – идеальное соединение металлов в сплаве.
Металловеды выделяют особое соотношение компонентов, при котором температура плавления минимальная. Когда составляют сплавы, то стараются подбирать количество используемых веществ, чтобы получать именно эвтектоидный сплав. Его механические свойства наилучшие из возможных. Кристаллические решетки образуют идеальные гранецентрированные положения атомов.
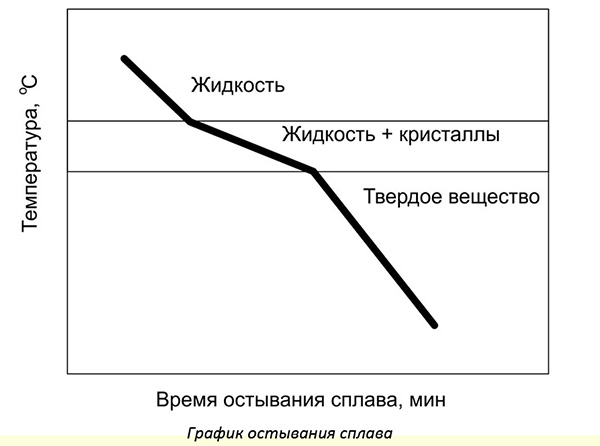
Изучают процесс кристаллизации путем исследования твердения образцов при охлаждении. Строят специальные графики, где наблюдают, как изменяется скорость охлаждения. Для разных сплавов имеются готовые диаграммы. Отмечая точки начала и конца кристаллизации, определяют состав сплава.
Сплав Вуда
В 1860 г. американский зубной техник Барнабас Вуд искал оптимальные соотношения компонентов, чтобы изготавливать зубы для клиентов при минимальных температурах плавления. Им был найден сплав, который имеет температуру плавления всего 60,2…68,5 ⁰С. Даже в горячей воде металл легко расплавляется. В него входят:
Сплавы для пайки
На практике многие сталкиваются с плавлением при пайке деталей. Если поверхности соединяемых материалов очищены от загрязнений и окислов, то их нетрудно спаять припоями. Принято делить припои на твердые и мягкие. Мягкие получили наибольшее распространение:
Их выпускают для предприятий, изготавливающих разные радиотехнические приборы.
Твердые припои на основе цинка, меди, серебра и висмута имеют более высокую температуру плавления:
Использование твердых припоев позволяет получать прочные соединения.
Внимание! Ср означает, что в составе припоя использовано серебро. Такие сплавы обладают минимальным электрическим сопротивлением.
Температура плавления неметаллов
Неметаллические материалы могут быть представлены в твердом и жидком виде. Неорганические вещества представлены в табл. 4.
Таблица 4, температура плавления неорганических неметаллов:
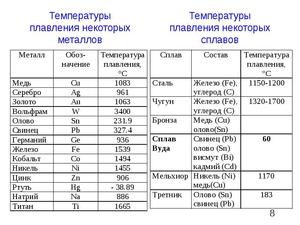
На практике для пользователей наибольший интерес представляют органические материалы: полиэтилен, полипропилен, воск, парафин и другие. Температура плавления некоторых веществ показана в табл. 5.
Таблица 5, температура плавления полимерных материалов:
Внимание! Под температурой стеклования понимают состояние, когда материал становится хрупким.
Видео: температура плавления известных металлов.
Топ-10 металлов с самыми низкими температурами плавления
У каждого элемента из группы металлов имеются уникальный перечень физических и химических свойств, благодаря которым те могут служить на благо человечества. Температура плавления – отнюдь не последний показатель в данном вопросе.
Если речь о металлических элементах, то здесь происходит преобразование из твердого состояния в жидкое при достижении пикового значения по температуре.
Сегодня мы разберем самый легкоплавкий металл и его ближайших соседей по характеристике – рассмотрим свойства, особенности и области применения элементов периодической системы в промышленности и повседневной жизни человека.
Наиболее легкоплавкие металлы
Плавление – процесс перехода из твердого состояния в жидкое. Он происходит под воздействием тепла, но зависит еще от ряда физических факторов, например от давления. Важную роль в том, насколько легко и тяжело вещество поддается плавлению, также играет его состав, размер кристаллов в решетке и прочность связей между атомами.
Наиболее легкоплавкими металлами являются галлий, ртуть, литий, олово, свинец, цинк, индий, висмут, таллий. Подробнее о некоторых из них читайте далее.








ТОП легкоплавкости + области применения
Металлов с температурой плавления ниже 600 градусов много, однако только небольшая их часть нашла широкое применение в промышленности и быту человека. Остальные – малоиспользуемые химические элементы таблицы Менделеева, составляющие менее 10% всего рынка промышленности по цветным и черным металлам.
Обратите внимание: легкоплавкие сплавы состоят из соответствующих металлов, но пиковая температура плавления таких элементов не должна превышать 232 градуса.
Если взглянуть на таблицу легкоплавких металлов выше, мы поймем, что граничным материалом будет именно олово. Все остальные легкоплавкие металлы, температура плавления которых выше, как легирующие добавки используются редко.
1) Обзор группы легкоплавких металлов промышленного назначения
Широчайшее применение имеет 9 легкоплавких материалов – цинк, свинец, кадмий, таллий, висмут, олово, индий, галлий и ртуть. Далее мы по каждому из элементов подадим краткую характеристику + область применения в быту и промышленности человеком.
А) Цинк (Zn)
| Распространенность | ★★★★★ (5.0 из 5.0) | Общая привлекательность в промышленности ★★★★★ 4.5 |
| Стоимость | ★★★★(4.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Первые упоминания цинка в неявном виде пришли к нам из древней Греции и Египта – он там был составляющим элементом латуни. Первое промышленное изготовление цинка было запущено в 1743 году в городе Бристоле, а в 1746 был разработан метод получения металла путем прокаливания окиси смеси с углем без доступа кислорода с дальнейшим охлаждением паров в холодильном оборудовании.
Разновидности латуни и температура ее плавления
Химические и физические свойства цинка:
В природе существует 65+ минералов с содержанием цинка. В земной коре металл содержится на уровне 8*10^(-3) %. В воде цинк также присутствует и активно мигрирует в термальных потоках на ровне со свинцом. Крупнейшие месторождения цинка – Иран, Австралия, Боливия и Казахстан.
Область применения цинка:
Физиологическая ценность цинка заключается в его катализирующих свойствах. Элемент является составляющей инсулина, а его поступление в организм обеспечивается через молоко, мясо и яйца. Недостаток цинка в почве приводит к возникновению болезней растений. В чистом виде металл мало токсичен.
В) Свинец (Pb)
| Распространенность | ★★★★★ (5.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★(3.0 из 5.0) |
На внешний вид, плюмбум – металл серебристого цвета с беловатым и голубоватым оттенками. Из-за широкого распространения и просты в обработке, свинец использовался еще с древних времен (датируется 6 400 лет до н. э.). Промышленная отладка производства свинца началась в 1840 году, а к концу 20-го века уровень его добычи снизился из-за понижения спроса. Металл начали замещать другими материалами, которые менее опасны для здоровья человека.
| Физические свойства | Химические свойства |
| Низкая теплопроводимость – 35 Вт/(м*к), но это при температуре в 0 градусов. | При взаимодействии с кислородом получаем оксиды. |
| Высокая пластичность материала. Изделия из олова не составит труда поцарапать, разрезать ножом или согнуть. | Хороший реагент для кислот. |
| Плавится при температуре в 328 градусов, а закипает при нагревании до 1750 градусов. | Взаимодействует с растворами щелочей. |
| Расположен в группе тяжелых металлов. Изначальная плотность в 11.34 грамма на сантиметр кубический постепенно падает по мере повышения температуры в окружении. | Некоторые соединения на основании свинца обладают повышенными кислотными свойствами, что переводят вещество в разряд окислителей. |
| При достижении точки температуры в 7.26 кельвина становится сверхпроводником. |
В основе производства свинца руды с галенитом. Через флотацию формируют концентрат с 50%-80% чистого вещества, а далее одним из 4 методов получают черновой свинец. Основными добытчиками свинца является США, Китай и Россия.
Где применяют свинец:
В медицине свинец применяется как защитник от излучения в рентгеновских аппаратах. Стоимость одного килограмма свинца более чем приемлема – 2-3 доллара. Нельзя забывать и о токсичности химического элемента. Хотя сам по себе свинец и не токсичен, того нельзя сказать о массе его производных соединений.
С) Кадмий (Cd)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★(3.0 из 5.0) |
Очередной мягкий и ковкий металл с проявлением тягучих свойств. По расцветке – это серебристо-белое вещество. С древних времен не распространялся. Открыт только в 1817 году немцем Штромейером. Название придумано тем же человеком, и происходит от руды, с которой добывали на то время цинк. Массовая доля кадмия в отношении массы земной коры составляет 130 миллиграмм на тонну. В воде элемент также присущ – от 0.11 микрограмма на литр. В природе имеется всего 6 минералов с содержанием кадмия, но из-за их широкого распространения, вещество по частоте проявления приравнивают цинку.
Физические свойства кадмия:
Почти 40% кадмиевого производства отправляется для создания антикоррозийных покрытий на другие сплавы. Кадмирование относится к электролитическим процедурам и один из лучших способов сделать детали с инструментами менее восприимчивыми к коррозии. Порядка 20% элемента используют в качестве добавки в красящие вещества. Из прочих областей применения – пленочные солнечные батареи, компонент полупроводников, пайка алюминия и криогенная техника. В больших концентрациях соединения на основе кадмия ядовиты.
D) Таллий (Tl)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★ 3.0 |
| Стоимость | ★★★★(4.0 из 5.0) | |
| Применение | ★★(2.0 из 5.0) |
Таллий относится к группе легкоплавких металлов – температура плавления от 304 градусов, а кипения – от 1473 Цельсия.
Открытие металла произошло в 1861 году англичанином Круксом через спектральный метод, а название получено из-за зеленых линий спектра. Дословно Таллий переводится с греческого как «зеленая ветвь». Таллий относится к элементам рассеянного типа. Существует только 7 минералов с содержанием частичек металла в неявном виде. Среднее содержание в рамках земной коры – 3.5*10 в (-5) степени.
Из физических свойств выделим сверхпроводимость при температуре выше 2.39 Кельвина, твердость по Моосу в 1.3 (по Бриннелю 20 МПа). По химии – реакции с неметаллами, хорошая растворимость в азотной и серной кислотах + инертность в отношении реакции с щелочами. Значительной биологической роли в жизнедеятельности человека талий не играет. Металл относится к ядам кумулятивного типа, а при больших концентрациях вещество способно вызвать поражения почек, нервной системы и желудочно-кишечного тракта.
E) Висмут (Bi)
| Распространенность | ★★★(3.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Физические свойства висмута:
Висмут относится к редким металлам. Ежегодная добыча в чистом виде едва ли достигает отметки к 6 200 тонн ежегодно. Основные поставщики вещества на мировой рынок – Германия, Монголия, Австралия, Перу и Россия. Цена на металл непостоянна и меняется от уровня спроса. В 2020 году, к примеру, 1 килограмм висмута можно приобрести за 12$.
Справочные значения веса стального круга
F) Олово (Sn)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
История олова начинается еще с 4 века до нашей эры, но в чистой форме вещество было получено только в 21 веке. Происхождение названия металла – чисто славянское. Температура плавления олова составляет 231 градус, а кипения – 2 620 по Цельсию. Разница между показателями более чем заметна. Модуль упругости 55 ГПа, а временное сопротивление на разрыв – 20 МПа. Твердость по Бринеллю 152 МПа у белого и 62 МПа у серого олова. Температура литья – 260-300 по Цельсию.
Область применения олова:
Олово относят к рассеянным редким элементам. В земной коре его процент разнится – от 2 до 8 умноженное на 10 в (-3) степени. Основным минералом для добычи олова считается касситерит, в котором содержится почти 80% чистого вещества. На втором месте – станнин, который более известен как оловянный колчедан (30%). Основные месторождения металла – Китай и Юго-восточная Азия. Достоверной информации о физиологическом воздействии олова на организм пока не имеется, но передозировки могут привести к отравлению и хроническим заболеваниям легких.
G) Индий (In)
| Распространенность | ★★(2.0 из 5.0) | Общая привлекательность в промышленности ★★★ 3.0 |
| Стоимость | ★★★(3.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Металл был открыт двумя немцами Рейхом и Рихтером в 1863 году. Многие могут предположить, что название сродни одноименной стране на карте мира, но на самом деле свое обозначение металл получил из-за синего цвета (индиго) линий в спектре. Вещество в природе можно добыть из 5 минералов, а его общая доля в отношении земной коры составляет всего 10 в (-5) степени, что делает вещество в чистом виде как редким, так и дорогим (от 100 долларов за 1 килограмм).
Где применяется индий:
Температура плавления металла составляет 157 градусов, а кипения – 2072 градуса. Критическая температура для возникновения сверхпроводимости составляет 3.404 К. Твердость по Бринеллю 9 МПа, а по Моосу 1.2. Производство индия происходит из отходов цинка, реже свинца и олова. Ярко выраженной биологической роли металл для человека не имеет.
Калькулятор веса листового металла
2) Какой самый легкоплавкий металл + область его применения
В данном разделе мы хотим остановиться на 2-х элементах, а не одном. С физической точки зрения, самым легкоплавким металлом является ртуть, но существует еще один сравнительно безопасный металл, который часто используют для наглядной демонстрации самого физического процесса – галлий. Давайте вкратце расскажем о каждом из них.
А) Ртуть – ТОП-1 по легкоплавкости в мире
В исторической справке металл известен с древности. Впервые чистую ртуть химическим путем получили в 1735 году. Сделал это швед-химик Брандт. По уровню распространения в природе, ртуть имеет концентрацию в 83 мг/тонну. Концентрация чистого вещества в ртутных рудах сравнительно высока и может достигать 2.8%-3%. В природе известно порядка 20 минералов с содержанием чистого вещества.
Плотность ртути меняется в зависимости ото температуры окружения. В нормальных условиях, при комнатной температуре – то 13 550 килограмм на метр кубический. Температура кипения чистого элемента составляет 357 градусов. Имеет диамагнетические свойства + способен образовывать с прочими металлами сплавы твердого и жидкого типов. В химическом плане ртуть малоактивная.
Области применения ртути:
Все соединения ртути, как и сам материал ядовиты, потому, широкого распространения элемент в промышленности и быту человека не приобрел. В 21 веке направления использования ртути можно с успехом заменить на более безопасные элементы. Да, чуть дороже, но здоровье превыше всего.
Развернутая информация о самом легкоплавком металле на земле:
Б) Галлий (Ga) – металл, тающий в руках
Если говорить о наглядности, то обойти стороной рассматриваемый металл нереально. Температура тела человека 36.6, а галлий тает при температуре в 29.8 градуса. То есть, если взять металл в руки, он начнет растекаться – забавное зрелище. Существование элемента было предсказано самим Менделеевым, но впервые выделить металл удалось только в 1875 году Де Буабодраном.
На тонну земной коры приходится порядка 19 грамм галлия. Металл является типичным рассеянным химэлементом у которого двойная геохимическая природа. В чистой форме встретить металл нельзя, но в отношении количества минералов с его содержанием, может дать фору многим. Основными месторождениями галлия является страны Юго-Западной Африки, Россия и некоторые страны СНГ.
Где применяется галлий:
Элемент относится к малотоксичным веществам + биологически важной роли в жизни человека не имеет. Хотя галлий и не самый легкоплавкий металл, его поведение в руках человека многих вводит в заблуждение.
Существуют и другие участники ряда металлов таблицы Менделеева с небольшой температурой плавления, но из-за их малой области применения, рассматривать в рамках нашего сайта их просто нет смысла.
Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Философский камень в пиаре ртути
История ртути неразрывно связана с развитием алхимии. Ученые упорно искали «философский камень», способный превращать любой металл в золото. В этих исследованиях они истратили тонны ртути. Философского камня не нашли, но очень продвинули вперед минералогию, химию и многие смежные науки.

Жидкая ртуть в ампуле
Познавательно: Торричелли, ученик Галилея, изобрел ртутный барометр. Прибор настолько точен, что им до сих пор оборудуют метеостанции, по нему проверяют работу других барометров.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий. Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках. При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.


Франций (27°C)

Элемент, занимающий 89-ю ячейку периодической таблицы — франций (Francium) — очень похож на цезий. Франций плавится при 27°C, но до этого неимоверно активный щелочной металл ещё требуется сберечь.
Мало того, что франций бурно реагирует буквально со всем подряд — он ещё и очень радиоактивен! Буквально через полчаса от килограмма франция останется — хорошо если горстка — разнообразных сильно излучающих продуктов деления.
Впрочем, в таких количествах его никто никогда и не видел. Неудивительно, что в природе этот элемент один из самых редко встречающихся. Да и практического применения ему так и не нашлось.
Индий
В качестве простого вещества индий очень светлый, ковкий и мягкий настолько, что даже оставляет след, если им провести по бумаге. Он также является одним из наиболее легкоплавких металлов, но воздействуют на него только температуры выше 157 °C. Закипает он при 2072 градусах.
Как и галлий, индий не образует собственных месторождений, но содержится в различных рудах. Благодаря своей рассеяности в природе металл довольно дорогой. Его применяют в микроэлектронике, для изготовления легкоплавких сплавов, припоев, жидкокристаллических экранов для техники.
Рубидий (39,31°C)

37-й элемент таблицы — рубидий (Rubidium) плавится всего при 39,31°C. Кусочек рубидия может растаять на блюдце как сливочное масло. Это лёгкий металл, его плотность лишь немного превышает плотность воды. Но реагирует с водой рубидий не менее бурно, чем его близкие родственники калий и натрий.
Рубидий удивителен своими химическими свойствами. Сам по себе щелочной металл очень легко вступает в разнообразные химические реакции. Но при этом соли рубидия и его сплавы с другими металлами являются хорошими катализаторами реакций. То есть, значительно ускоряют процесс, при этом совершенно не расходуясь сами по себе. Это делает рубидий ценным материалом для химической промышленности и радиоэлектроники.
Олово
Олово плавится от температуры выше 231 градуса по Цельсию. Это пластичный и мягкий металл, светло-серебристого цвета. Оно существует четырех аллотропных модификациях, две из них появляются только при высоком давлении.
Олово довольно рассеяно в природе, но может образовывать собственные минералы, например, станнин и касситерит. Его используют в качестве покрытия для металлов для усиления их устойчивости к коррозии, а также для производства жести, фольги, разнообразных сплавов, посуды и деталей для музыкальных инструментов.
Жидкое серебро в нашем доме
Почти в каждом доме есть ртутный градусник, и разбить его очень просто. Ртуть окажется на полу, это создаст опасность для здоровья.
Как правильно собрать шарики ртути:
Нельзя собирать разлившийся металл веником или пылесосом.
Познавательно: если вы купили термометр, а в нем красная жидкость — не думайте, что это легендарная красная ртуть. Это просто спиртовой, а не ртутный термометр.
Литий
Литий – наиболее легкоплавкий металл, который становится жидкостью при температуре 180 градусов. Он мягкий, хорошо поддается ковке и механической обработке. Он относится к щелочным металлам, но проявляет активность гораздо хуже остальных представителей группы. Он медленно реагирует с влажным воздухом, а в сухой атмосфере остается практически стабильным
Металл встречается в сподумене, лепидолите, в месторождениях с оловом, висмутом и вольфрамом, содержится в морской воде и в звездных космических объектах. Литий часто используется для изготовления гальванических элементов, аккумуляторов, применяют в качестве окислителя, а также в пиротехнике. В сплавах с кадмием, медью и алюминием используется в космической, военной и авиационной технике.
Калий (63,5°C)

Близкий родственник натрия — калий. Элемент №19 (Kalium) также бурно реагирует с водой, образуя щёлочь, и также легкоплавок — 63,5°C. А вот съедобных соединений калия почти нет, и в этом он полная противоположность натрию. Хотя в ограниченно малых количествах организму всё-таки необходим (микроэлемент).
В чистом виде калий практического применения не имеет. Но его многочисленные соединения с древних времён известны как удобрения, моющие средства, важные компоненты многих химических процессов.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Воздействие на организм
Самый легкоплавкий металл обладает первой степенью токсичности. Он испаряется уже при комнатной температуре, и чем воздух горячее, тем выше скорость испарения. На организм человека ртуть действует отравляюще, поражая нервную, пищеварительную, дыхательную и другие системы. Это может привести к летальному исходу. Симптомы проявляются спустя 8-24 часа.
Длительное воздействие небольших доз ртути проявляется в виде хронических недугов. Человек становится раздражительным и вспыльчивым, страдает от нехватки сна и головных болей, теряет работоспособность, быстро устает.
Острые отравления могут иметь похожие симптомы вначале. Они также сопровождаются повышенной температурой, слабостью, рвотой и тошнотой, болью в желудке, дрожью во всем теле или в отдельных его частях. Вещество поражает почки, что проявляется частыми позывами к мочеиспусканию.
Широкое применение ртути нередко было причиной профессиональных отравлений. Так, в средние века её использовали для изготовления фетра для шляп. Симптомы, которые появлялись у мастеров, называли «болезнью старого шляпника».
Пищевые отравления ртутью возможны у тех, кто любит морепродукты. Металл отлично усваивается организмом морских обитателей, постепенно накапливаясь в нём. В регионах, где люди постоянно употребляют рыбу и другие продукты моря, могут возникать симптомы хронического отравления. Особенно часто они встречаются у жителей прибрежных областей Канады, Колумбии, Бразилии и Китая.