e cadherin что это
E-Cadherin
Е-кадгерин – это белок адгезии, экспрессирующийся в клетках эпителия. Антитела к Е-кадгерину окрашивают железистый эпителий, а также аденокарциномы легкого, желудочно-кишечного тракта и яичников. Также это антитело используется для дифференциации протокового (который окрашивается позитивно) и лобулярного рака молочных желез. Также отмечается положительная реакция антител к Е-кадгерину с некоторыми видами карциномы щитовидной железы. Потеря экспрессии Е-кадгерина рассматривается как неблагоприятный прогностический показатель при карциноме молочных желез и немелкоклеточной карциноме легкого.
Цена предоставляется по запросу
Наши преимущества:
Только качественные
официальные поставки
Минимально возможные
сроки поставок
Доставка по всей России с соблюдением температурного режима
Полный пакет документов
На данный момент мы сотрудничаем с ведущими зарубежными производителями лабораторных реактивов. Нашими клиентами являются как негосударственные, так и государственных учреждения, в том числе медицинские организации Москвы и других городов России. Для постоянных клиентов предусмотрена система скидок.
2003–2021 © ООО «Микротесты в биологии, медицине и ветеринарии». Официальный дистрибьютор ведущих производителей.
+7 (495) 969-98-26
Иммуногистохимически положительный статус E-cadherin не всегда является прогностическим для хорошего прогноза рака молочной железы человека
Эти авторы внесли одинаковый вклад в работу.
При первичном раке молочной железы дихотомическая классификация экспрессии E-cadherin, согласно произвольному обрезанию, может быть неадекватной и приводить к потере прогностической значимости или противопоказанию прогностических признаков. Мы нацелились на оценку прогностической ценности высоких и низких уровней E-cadherin в последовательных сериях случаев (204 случая) односторонних узлоотрицательных пациентов с недокулярным раком молочной железы с 8-летним средним наблюдением и которые не получали никаких адъювантная терапия после операции.
Экспрессию E-кадгерина исследовали методом иммуногистохимии и оценивали по общепринятой оценке (0, 1+, 2+, 3+). Для визуализации ассоциаций как категориальных, так и непрерывных переменных использовался множественный анализ соответствия. Влияние экспрессии E-cadherin на результат пациентов оценивали по кривым выживаемости без событий по методу Каплана-Мейера и модели Кокса с пропорциональной опасностью.
Относительно промежуточных значений экспрессии E-cadherin (2+), высокого (3+) или низкого (0 — 1+) уровней экспрессии E-кадгерина было отрицательное прогностическое воздействие. Фактически, у обоих пациентов с уровнем экспрессии E-cadherin с низким до нуля (оценка от 0 до 1+) и у пациентов с высоким уровнем экспрессии E-кадгерина (оценка 3+) наблюдался повышенный риск отказа (соответственно, риск (HR) = 1,71, доверительный интервал (CI) = 0,72-4,06 и HR = 4,22, CI = 1,406-12,66) и интересная связь с молодым возрастом.
Полученные данные подтверждают доказательства того, что высокие значения экспрессии E-cadherin не являются прогностическими для хорошего прогноза и могут помочь объяснить противоречивые данные о прогностическом влиянии E-cadherin при раке молочной железы при оценке на дихотомической основе.
Мы рассмотрели 234 последовательных пациента, которым в период с января 1989 года по декабрь 1993 года в хирургических отделениях Университета Феррары С. Анна или в хирургических отделениях больниц провинции Феррара была перенесена операция на рак молочной железы. Информированное письменное согласие было получено от всех пациентов, и исследование было одобрено Исследовательским комитетом по этике Университета Феррары. У всех пациентов был нелебулярный рак, и после операции не проводилась адъювантная терапия, потому что поддиапазонный лимфатический узел отрицательный (pN0) при постановке диагноза. Дополнительными критериями были: патологическая стадия Т1-Т3, наличие по меньшей мере 10 рециклизированных подмышечных лимфатических узлов, отсутствие синхронных двусторонних опухолей или любая другая злокачественность до диагностики рака молочной железы и до 6 месяцев после операции, отсутствие отдаленных метастазов при постановке диагноза и повышение до 6 месяцев после операции и без нео-адъювантной терапии. Клинические исходные данные и данные о наблюдении пациентов (дата и место рецидива, последнее время наблюдения, дата смерти и причина смерти) были извлечены из реестра рака Феррары. Также были собраны данные о возрасте пациента, гистологии опухолей, патологической стадии, градуировке, рецепторе эстрогена (ER) и статусе рецептора прогестерона. После оценки рутинных биологических маркеров для 204 пациентов (таблица 1) для иммуногистохимической оценки экспрессии E-кадгерина был доступен остаточный вложенный в парафин тканевый материал первичной опухоли. Протокол этого исследования был одобрен советом Министерства Университета и Исследований («Идентификация и валидация новых маркеров метастазирующего фенотипа рака молочной железы», прот. MM06095812_006, 2000).
Эта статья была подготовлена в соответствии с рекомендациями по отчетности для исследований отчетности маркеров опухолей (McShane et al, 2005).
Блоки TMA собирались следующим образом. Игла с истинной средой (внутренний диаметр 4 мм) использовалась для пробивания отверстий 3 мм в блоке получателя. Донорные блоки фиксированных формалином, содержащих парафин архивные образцы первичной опухоли были получены после переоценки покрытых гематоксилин- и эозиновыми слайдами. Были идентифицированы представительные области опухолей, из каждого донорского блока удалены сердечники диаметром 4 мм из опухолевых тканей и перенесены в блок реципиента (24 образца на слайд). Затем микрочипы ткани инкубировали в течение 15 мин при 37 ° С, чтобы сердцевины опухолей твердо прилипали к блоку реципиента. Последовательные участки толщиной 5 мкм были вырезаны из ТМА и установлены на поляризованных слайдах. Слайды депарафинировали, регидратировали и обрабатывали 3% H2O2 в метаноле в течение 10 мин для блокирования эндогенной активности пероксидазы. Слайды обрабатывали в микроволновой печи в TEC-буфере (Трис-цитрат-ЭДТА), pH 7,8, чтобы разоблачить антигенные сайты после фиксации формалина. IHC проводили с помощью автоматизированного иммуноанализа (Ventana NEXES, Medical System, Tucson, AZ, USA). Слайды окрашивали для E-cadherin с использованием антитела ECH-6 (Medite, Castelnuovo Del Garda, Italy) и набора Voxastain ABC peroxidase (Vector Laboratories, DBA Italia, Segrate, Italy) для выявления связывания антитела. В качестве отрицательных контролей использовали слайды, обработанные нормальной сывороткой или антителами, совместимыми с изотипом. Эндогенный биотин был насыщен комплектом блокировки биотина (Vector Laboratories). Два патолога (MP и PQ) независимо исследовали все разделы TMA. Для каждой опухоли подсчитывали по меньшей мере 400 клеток и регистрировали процент иммуноокрашенных клеток. Выражение E-cadherin оценивалось по продукту между коэффициентом интенсивности (0, отрицательным, 1, низким, 2, умеренным, 3, сильным) и частотой коэффициента положительности (0, без окрашенных клеток, 1, 1-9% 2, 10-49% 3, 50-79% 4, 80-100%) и классифицируется следующим образом: 0, отрицательный результат; 1+, оценка 1-4; 2+, оценка 5-8; 3+, оценка 9-12. На рисунке 1 показаны некоторые типичные примеры для разных уровней экспрессии E-cadherin.
Связь между E-cadherin и другими клинико-биологическими маркерами, а именно возраст пациента, гистологический тип, градуировка, pT и статус ER, была исследована посредством множественного анализа соответствия (MCA), который визуализирует на двумерном графике ассоциацию как категоричных, так и непрерывных переменных ( Greenacre, 1994; Marubini and Valsecchi, 1995). Для последнего MCA имеет то преимущество, что не подразумевает ни линейности, ни специфических характеристик распределения, а также позволяет визуализировать связь между маркерами и опухолями. Точки на графике представляют собой опухоли, тогда как маркеры помечены в соответствии с их категорией. Точки, близкие друг к другу на графике, соответствуют опухолям со схожими характеристиками, тогда как метки близких маркеров соответствуют связанным маркерным категориям. Использование двумерного сюжета, легко интерпретируемого, возможно за счет потери некоторой информации о структуре ассоциаций. Расстояние между точками основано на х2-метрике, тогда как мера на осях не имеет физического смысла. Чтобы помочь интерпретировать результаты, кластерный анализ был выполнен с использованием координат точек, представляющих опухоли, вычисленных MCA. Индекс силуэта (Kaufman and Rousseeuw, 1990) использовался для выбора числа рассматриваемых кластеров.
На рисунке 2 показан график анализа MCA, в котором первые две факториальные оси объясняют 95% общей изменчивости (первая ось: 64% вторая ось: 28%). Горизонтальная ось разделяет справа, G1, ER> 10%, «другую гистологию», пациентов с постменопаузой и E-cadherin 2+, тогда как слева — низкие значения ER, G3 и пациентов с менопаузой. Вертикальная ось в основном отделяет оценку E-cadherin 0 и 3+. Кластерный анализ, проведенный по результатам МКА, выделил три кластера пациентов, представленных на графике разными цветами. Зеленый кластер характеризуется пациентами с некоторыми благоприятными характеристиками (низкий уровень гистологии опухолей и пери / постменопаузальный статус). Черный кластер характеризуется предклимактерическими пациентами, имеющими опухоль, связанную с менее благоприятными характеристиками: низкие значения ER и высокий гистологический класс. Красный кластер состоит в основном из молодых и пожилых пациентов, имеющих опухоль, характеризующуюся промежуточным гистологическим классом. E-cadherin 1+ ассоциировался с черным кластером, тогда как E-cadherin 3+ ассоциировался с красным кластером. E-cadherin 2+ ассоциировался как с зеленым, так и с красным кластером, тогда как E-cadherin 0 ассоциировался как с красными, так и с черными кластерами. Примечательно, что категория E-cadherin 3+ была построена вблизи категории молодых пациентов. Хотя этот результат основан на низком числе пациентов в категориях E-cadherin 3+ и 34-40 лет, он предлагает возможную интересную связь между высокими уровнями E-cadherin и более агрессивным заболеванием.
Последующее исследование было закрыто 31 декабря 2002 года. Медианное наблюдение за 204 пациентами составило 118 месяцев, хотя оно было сокращено через 8 лет, когда только около 12% пациентов были потеряны для наблюдения. Во время наблюдения 23 пациента развивали отдаленные метастазы, 14 — местный рецидив, 8 — контралатеральная опухоль, 8 — другая злокачественность и 37 — как первое событие. Оценки выживаемости Каплана-Мейера, согласно различным оценкам E-cadherin, показаны на рисунке 3. HR для E-cadherin 1+ по сравнению с E-cadherin 0 составлял 1,04 (P = 0,88), для E-cadherin 2+ против E-cadherin 1+ составляет 0,62 (P = 0,22), а для E-cadherin 3+ по сравнению с E-cadherin 2+ составляет 2,94 (P = 0,03). Результаты многопараметрической модели представлены в таблице 2, где E-cadherin 0 и 1+ сгруппированы вместе. У пациентов, у которых опухоль имела экспрессию E-cadherin с низким до нуля (оценка от 0 до 1+), наблюдалась тенденция к увеличению риска неудачи у пациентов с промежуточной экспрессией E-cadherin (оценка 2+ HR = 1,71, CI = 0,72- 4,06). Примечательно также, что пациенты, у которых опухоль выражена высокими уровнями E-cadherin (оценка 3+), имели неблагоприятный исход по сравнению с пациентами с E-cadherin 2+ (HR = 4,22, CI = 1,41-12,66). Прогностическое влияние других переменных, проанализированных, например, на более низкий риск отказа, связанного с экспрессией ER, соответствовало ожидаемому из предыдущих исследований.
В заключение, представленные результаты показывают, что оценка IHC экспрессии E-кадгерина с точки зрения отрицательного / положительного статуса должна быть слишком наивной, поскольку позитивность E-cadherin может фактически скрыть сложные биологические взаимодействия, которые могут определять ход прогрессирования опухоли и исход заболевания. Гипотеза, которая, безусловно, заслуживает дальнейшего изучения.
Мы благодарим доктора Эроса Магри и доктора Анна Керубино за техническую помощь. Эта работа была поддержана Фондом Касса ди Риспармио делла Провинция ди Кьети, ЕС NoE Biopattern (FP6-2002-IST-1 № 508803), Итальянская ассоциация исследований рака (AIRC, Италия), ABO и ABO Project SpA (грант VE01D0019) и передача стипендий Марии Кюри — рамочная программа ЕС VI (контракт 014541).
Авторы объявили, что нет никаких конфликтов интересов.
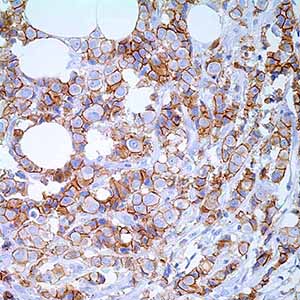
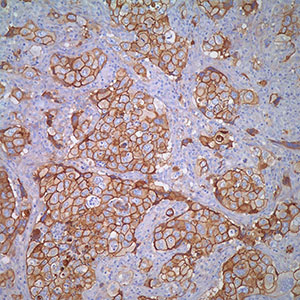
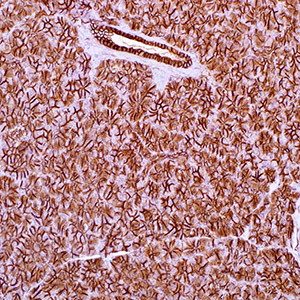
Иммуногистохимический анализ экспрессии рака молочной железы E-cadherin. (A, B) Проникающие через кровь проточные раковые опухоли. Оба случая экспрессируют E-cadherin почти в 100% клеток, с высокими, по существу однородными уровнями экспрессии мембран (3+ B): нормальный грудной канал; соответствующие уровни экспрессии E-кадгерина использовались как внутренняя ссылка (2+). (C, D). Проникающие в кровь проточные раковые опухоли. Оба случая выражают E-cadherin на промежуточных уровнях (2+). Однако в случае (C) почти 100% клеток экспрессируют E-кадгерин, тогда как значительная гетерогенность наблюдается в (D) случае. (E, F) Репрезентативные случаи рака молочной железы с низким (1+) уровнем экспрессии E-кадгерина. (E) транквилизационный рак молочной железы; (F) карциномы молочной железы муцинового типа.
Ассоциация среди E-cadherin (E-cad), рецептор эстрогена (ER), гистологический тип, градуировка, патологическая стадия (pT) и возраст. На графике множественного соответствия анализируются проекции категорий E-cadherin (оценка 0, 1+, 2+, 3+), ER (0, 10,> 10%), гистологический тип (протоковый, другой), градуировка ( G1, G2, G3) и возраст (34-40, 41-50, 51-55, 56-70, 71-90). Категории переменных, близких друг к другу, соответствуют связанным маркерным категориям и клиническим характеристикам. Цветные точки, представленные на графике, соответствуют 234 опухолям, включенным в исследование. Опухоли с похожими профилями проецируются рядом друг с другом. Профили описываются положением различных категорий маркеров. Более того, чтобы помочь интерпретировать сюжет, был проведен кластерный анализ, чтобы выделить опухоли с похожими профилями. Три кластера были выбраны с использованием конкретных индексов, а точки были окрашены соответственно.
Кривые выживаемости без событий Kaplan-Meier стратифицированы в соответствии с уровнем экспрессии E-cadherin (E-cad). Пациенты с низким до нуля (оценка от 0 до 1+) или высокая (оценка 3+) экспрессии E-cadherin демонстрируют повышенный риск рецидива в отношении пациентов с промежуточным уровнем экспрессии E-cadherin (оценка 2+).
Аббревиатура: pT stage = патологический этап.
Сокращения: CI = доверительный интервал; ER = рецептор эстрогена; HR = отношение риска.
Комплекс E-cadherin / catenin: важный привратник в опухолегенезе рака молочной железы и злокачественная прогрессия
E-cadherin представляет собой клеточный адгезионный белок, который играет важную роль в эпителиальной дифференцировке. Данные из модельных систем показывают, что E-cadherin является мощным ингибитором инвазии / опухоли рака молочной железы. Было установлено, что в соответствии с этой ролью в прогрессировании рака молочной железы частичная или полная потеря экспрессии E-cadherin коррелирует с плохим прогнозом у пациентов с раком молочной железы. Ген E-cadherin (CDH1) расположен на хромосоме человека 16q22.1, регионе, который часто страдает от потери гетерозиготности при спорадическом раке молочной железы. Инвазивные лобулярные карциномы молочной железы, которые обычно полностью отрицательны к E-кадгерину, часто показывают инактивирующие мутации в сочетании с потерей гетерозиготности аллеля CDH1 дикого типа. Мутации были обнаружены на ранних неинвазивных стадиях, что связывание мутаций E-cadherin с потерей контроля роста клеток и определение CDH1 в качестве опухолевого супрессора для подтипа лобулярного рака молочной железы. Канальные раковые опухоли в целом показывают гетерогенную потерю экспрессии E-cadherin, связанную с эпигенетической транскрипционной регуляцией. Предполагается, что микроокружение на инвазивном фронте временно подавляет транскрипцию E-cadherin. Это может быть связано с индукцией неэпителиальных кадгеринов.
Злокачественный рак молочной железы — это заболевание, возникающее в проточном и лобулярном эпителии молочной железы. Межклеточные взаимодействия имеют решающее значение для процессов динамической дифференциации, периодически активируемых в течение жизни в нормальном грудном эпителии, а также для индукции и поддержания дифференцированных тканей у взрослых. В последние несколько лет наблюдается повышенный интерес к адгезии клеток-клеток, опосредованной E-кадгерином, и адгезии клеток-внеклеточных матриц в качестве основных медиаторов эпителиальной дифференцировки.
Грудь E-cadherin выражается у нормальных взрослых в эпителиальных клетках просвета, тогда как экспрессия P-кадгерина ограничивается миоэпителиальными клетками [9,10]. Временная подавление E-cadherin была обнаружена у почтенных дольков, вторгающихся в строму ткани груди [11]. Изменения в нормальной картине экспрессии комплекса E-cadherin / catenin были обнаружены при различных раковых заболеваниях человека. При раке молочной железы, вообще говоря, частичная или полная потеря экспрессии E-cadherin коррелирует с потерей характеристик дифференциации, приобретением инвазивности, увеличением степени опухоли, метастатическим поведением и плохими прогнозами [12,13,14,15]. Однако, принимая во внимание два основных гистологических подтипа рака молочной железы, были найдены различные способы модуляции экспрессии E-cadherin. В то время как инфильтрирующие протоковые раки молочной железы в основном не показывают или только гетерогенно уменьшенную экспрессию E-cadherin, инфильтративные дольковые карциномы молочной железы (ILC) в большинстве случаев (85%) полностью являются E-cadherin-negative [9,16,17,18,19 ]. Другими работниками сообщалось о значительно меньшем отношении E-кадгерин-отрицательных по сравнению с E-кадгерин-положительными образцами ILC [19,20]. Это расхождение может быть частично связано с диагностическим изменением применительно к лобулярным карциномам [21].
В дополнение к потере экспрессии E-кадгерина в ILC наблюдалась одновременная потеря экспрессии α-катенина и экспрессии β-катенина [22]. Интересно, что в меньшинстве (15%) случаев ILC сохраняется экспрессия E-cadherin и catenins. Однако в этих случаях экспрессия E-кадгерина является нетипичной, поскольку она неполяризована (то есть опухолевые клетки окрашиваются по всей поверхности), указывая на дисфункцию нормальных адгезионных свойств клеток [19,20,22]. Интригующим является вывод о том, что, хотя первичные протоковые и лобулярные раковые опухоли молочной железы могут проявлять частичную или полную потерю экспрессии E-кадгерина, их производные метастазы могут проявлять сильную экспрессию E-кадгерина [23, 24]. Это говорит о том, что переходные механизмы подавления E-кадгерина могут быть вовлечены в злокачественные раковые образования без необратимых мутаций гена E-cadherin. Наблюдаемые переключатели экспрессии кадгерина в клеточных линиях рака молочной железы и опухолях также важны [25, 26]. Высококачественные поражения протоковой молочной железы с уменьшенной экспрессией E-cadherin могут проявлять аномальную экспрессию P-кадгерина в люминальных клетках. Более того, снижение экспрессии E-кадгерина в клетках рака молочной железы часто связано с неправильной экспрессией N-кадгерина и кадгерина-11, которые обычно экспрессируются в мезенхимальных клетках. Принудительная экспрессия N-кадгерина в клетках рака молочной железы с положительным E-кадгерином коррелирует с инвазией и подвижностью, что указывает на то, что N-кадгерин играет важную роль в продвижении этих злокачественных признаков [26].
Усилия на аллелотип рака молочной железы показали одновременную потерю гетерозиготности (LOH) на множественных хромосомных участках, причем LOH при 16q является одним из наиболее распространенных событий (52,3%) при спорадическом раке молочной железы [27]. Это указывает на значительную роль генов в этой хромосомной области для создания спорадического рака молочной железы. Ген E-cadherin (CDH1) относится к хромосоме человека 16q22.1 [28]. Соматически приобретенные мутации в CDH1 были обнаружены у примерно 56% дольковых опухолей молочной железы, как правило (> 90%) в сочетании с потерей аллеля дикого типа, в то время как мутации в первичных карциномах грудной железы [28,29] не обнаружены. Большинство из этих соматических мутаций приводят к преждевременным стоп-кодонам в результате вставок, делеций и бессмысленных мутаций. По прогнозам, большинство этих мутаций сдвига рамки и бессмыслицы генерируют секретированные фрагменты E-кадгерина, функциональность этого основного белка клеточной клеточной клетки теряется. Другие связанные с раком мутации E-cadherin также приводят к повреждению белков. Отличительная инвазивная картина роста, характерная для лобулярного рака молочной железы, полностью совместима с этой функциональной инактивацией. Обнаружение того, что потеря иммунореактивности E-cadherin и соответствующих мутаций уже присутствует в ранних неинвазивных лобулярных карциномах in situ (LCIS), интригует [18]. Это указывает на подлинную роль супрессора опухоли для E-cadherin во время спорадического развития рака молочной железы, в дополнение к ранее описанной роли супрессора вторжения. Экспериментальное доказательство эффективности роли в контроле клеточной пролиферации происходит из экспериментов in vitro и in vivo с E-кадгерин-отрицательными клетками рака молочной железы. Принудительная экспрессия E-кадгерина в этих клетках приводила к значительному ингибированию роста как в клеточной культуре, так и в виде опухолей у мышей [4]. Эта уменьшенная способность к росту может быть связана с повышенной экспрессией ингибитора циклинзависимой киназы p27KIP1 [7].
Однако молекулярная основа смешанных типов проточных / лобулярных опухолей молочной железы остается загадочной. Такой смешанный тип рака молочной железы встречается как на стадии развития, так и на месте. Это может указывать на то, что лобулярный компонент в этих конкретных опухолях молочной железы может происходить из карциномы протоков (in situ или инфильтративные варианты) через инактивацию E-кадгерина. Это было бы полностью совместимо с более ранними результатами в карциномах со смешанными желудочками, где мутации E-cadherin наблюдались исключительно в диффузном компоненте опухолей [30].
Можно ожидать, что полная потеря экспрессии E-cadherin приведет к увеличению уровней свободного цитоплазматического или ядерного β-catenin. Ядерные формы β-катенина накапливаются в колоректальных раках из-за мутаций в сигнальном пути Wnt, в том числе мутации мутаций аденоматозного полипоза и стабилизации мутаций β-catenin [2]. Результатом является взаимодействие β-катенина с факторами транскрипции семейства фактора лимфоидного фактора-Т-клеточного фактора в ядре и модуляцией экспрессии генов. Сопутствующая потеря экспрессии α-катенина и экспрессия β-катенина в ILC с мутированным геном CDH1 [22], однако, исключает возможную активацию передачи сигналов Wnt путем накопления свободного цитоплазматического или ядерного β-катенина в этих конкретных случаях рака молочной железы. Действительно, в последнее время стало ясно, что клеточные линии либо лобулярного, либо протокового происхождения с потерей экспрессии E-cadherin не показывают усиленной передачи сигналов Wnt [31]. Тем не менее экспрессия стабилизированной транскрипционно-активной формы β-катенина в молочной железе трансгенных мышей приводила к дифференцировке нормальной железы и индуцировала легкорастущие аденокарциномы с избыточной экспрессией как c-Myc, так и cyclin D1 [32]. Удивительно, но для ILC с дефектным комплексом E-cadherin / catenin, но без детектируемых мутаций E-cadherin до сих пор не было найдено доказательств мутационной инактивации α-catenin или β-catenin [33]. В конфликте с мутационными данными из первичных опухолей также сообщается, что 20% (3/15) линий рака молочной железы протокового происхождения несут инактивирующие мутации E-cadherin в сочетании с LOH [31]. Причина этого расхождения в настоящее время неясна: это может быть отражением отклонения от гистопатологического диагноза или может быть обусловлено гетерогенностью опухолей в первичных карциномах протоков с едва заметным меньшим количеством клеток типа ILC с мутациями E-cadherin. Более того, существование клеточных линий рака молочной железы протоков с потерей функционального E-кадгерина может быть результатом клонирования in vitro клонирования из-за преимущества роста, обеспечиваемого инактивацией гена E-cadherin.
Для большинства первичных опухолей молочной железы и клеточных линий гистотипа протоков нельзя было идентифицировать мутации E-cadherin, несмотря на то, что эти опухоли часто демонстрируют поразительно уменьшенный ген E-cadherin и экспрессию белка. Возможные механизмы для объяснения этой сокращенной экспрессии включают перегруппировки хроматина, гиперметилирование и изменения в трансфакторном связывании [41, 42]. Было продемонстрировано, что гиперметилирование промотора CDH1 и перекрывающегося островка 5 CpG коррелирует с потерей экспрессии E-кадгерина на уровне транскрипции для различных линий рака молочной железы и первичных раковых опухолей молочной железы [43]. Кроме того, недавно было сообщено о нескольких инфильтративных дольковых раковых опухолях с метилированными промоторными последовательностями CDH1 [20]. Это могло бы служить вторым событием инактивации гена в сочетании с LOH или соматическими мутациями CDH1, хотя предполагалось также, что метилирование биаллелей также происходит. Лечение двух линий клеток рака молочной железы с помощью ингибитора метилирования ДНК 5-аза-2′-дезоксицитидина приводило к незначительной регуляции уровня мРНК и белка E-cadherin [43]. Интересно отметить, что гетерогенное метилирование этого 5′-CpG-острова, как сообщается, заметно возрастает при злокачественной прогрессии от карциномы протоков in situ до метастатических поражений [44]. Эти эпигенетические изменения кажутся динамическими, поскольку их можно имитировать in vitro в зависимости от микроэнвайронных условий, благоприятствующих либо гомотипической клеточной адгезии (рост как сфероиды), либо инвазии in vitro [45].
Однако пока неясно, можно ли экстраполировать прямое участие гиперметилирования в качестве преобладающего механизма в подавлении экспрессии гена E-cadherin для большинства случаев рака молочной железы, показывая промотор метилированного гена. Действительно, интригует, что экспрессия E-cadherin не может быть восстановлена в гибридах соматических клеток, возникающих в результате слияния между позитивными клеточными линиями E-cadherin и линиями клеток с метилированным неактивным промотором E-кадгерина [46]. Помимо этой доминантной репрессии была замечена невозможность реактивации экспрессии E-кадгерина обработкой 5-аза-2′-дезоксицитидином, что указывает на то, что потеря экспрессии мРНК E-кадгерина связана не только с гиперметилированием [47]. Поддержка механизма транспрессии действует недавно, идентифицируя транскрипционный фактор Snail, связывающийся непосредственно с E2-коробками в промоторе E-cadherin и сильно подавляющий его транскрипцию [48,49]. Улитка высоко экспрессируется в клеточных линиях рака молочной железы с отрицательной обратной связью с E-кадгерином, в том числе с метилированными островами 5 CpG. В этом контексте интересно отметить, что высокая экспрессия интегрин-связанной киназы в эпителиальных клетках молочной железы индуцировала эпителиальный → мезенхимальный переход, который был связан с потерей экспрессии E-кадгерина [50]. Недавно выяснилось, что связанная с интегрином киназа активирует промотор Унайла в клеточных линиях колоректального рака с мутациями аденоматозных полипозных коликов [51]. Более того, сообщалось, что транскрипция гена E-cadherin ингибируется в клетках рака молочной железы сверхэкспрессией erbB2, протоонкоген часто сверхэкспрессируется при раке молочной железы [52]. Трансформирующий фактор роста-β, который играет важную тормозную роль в лобулоальвеолярном развитии при сверхэкспрессии in vivo в молочной железе [53], также способен подавлять транскрипцию E-кадгерина в клетках молочной железы [54, 55]. Поэтому наиболее интересно, что двуручный белок SIP1 (ZEB2) с цинковым пальцем с двусторонним связыванием, который первоначально изолирован на основе его взаимодействия с трансформирующими β-регулируемыми белками Smad-фактора роста, может подавлять E-кадгерин и индуцировать инвазивность [ 56]. Различные E-cadherin-отрицательные линии рака молочной железы и толстой кишки выражают SIP1, в том числе с метилированным промотором E-кадгерина. Поэтому может оказаться целесообразным искать Улитки и SIP1-индуцирующие факторы в микроокружении инвазивных частей злокачественных опухолей молочной железы.
Сегодня, несомненно, инактивация E-cadherin играет важную роль в развитии части спорадического рака молочной железы. Высокий уровень полной и необратимой инактивации E-кадгерина в инфильтративном дольковом раке молочной железы свидетельствует о роли E-кадгерина в качестве подлинного опухолевого супрессора в этом специфическом гистологическом подклассе спорадических молочных желез. Это подтверждается также тем фактом, что E-cadherin уже инактивирован в раннем неинвазивном LCIS, что противоречит модели с ограниченной ролью E-cadherin как только подавителя вторжения. Гетерогенная потеря экспрессии E-кадгерина обычно наблюдается при раке молочной железы протоков. Это отрицательное регулирование, по-видимому, обратимо на уровне транскрипции, что позволяет повторно экспрессировать на вторичном метастатическом участке опухоли. По мере того, как основные механизмы и соответствующие ключевые молекулы становятся последовательно идентифицированными, это открывает возможность разработки противоопухолевых и анти-инвазионных стратегий, направленных на функциональное усиление E-кадгерина при раке молочной железы.
ILC = инфильтративные лобулярные карциномы молочной железы; LCIS = дольковая карцинома in situ; LOH = потеря гетерозиготности.