какой металл может болеть чумой
о л о в о
металл, «болеющий чумой»
• металл, защищающий другие металлы от коррозии
• металл, из которого был сделан стойкий солдатик в сказке Андерсена
• металл, который в избытке можно добыть с поверхности консервных банок
• металл, применяемый в качестве припоя
• мягкий ковкий серебристо-белый металл
• мягкий металл, применяемый для пайки
• один из семи металлов, которые персы носили от сглаза
• серебристо-белый металл, мягкий и пластичный
• солдатский металл (сказочное)
• химический элемент, мягкий серебристо-белый металл
• по-латински «Stannum» (станнум)
• металл для лужения
• химический элемент, металл
• металл, ставший причиной гибели экспедиции Роберта Скотта на Южный полюс
• серебристая капелька на паяльнике
• металл для лудильщика
• мягкий металл колец Альманзора
• смесь солей этого металла — «желтая композиция» — издавна использовалась как краситель для шерсти
• из какого металла делают «белую жесть»?
• латинское название этого металла переводится, как «твердый», хотя он один из самых мягких и легкоплавких
• переведите с латинского слово «станнум»
• химический элемент, Sn
• материал для стойких солдатиков
• тяжелый и мягкий металл
• металл для солдатиков
• хрупкий на морозе металл
• после индия у Менделеева
• покрытие консервных банок
• металл для стойких солдатиков
• плоть игрушечной армии
• касситерит это чья руда?
• солдатский металл (сказоч.)
• металл колец Альманзора
• из чего делают «белую жесть»?
• капелька на паяльнике
• металл в составе припоев
• между индием и сурьмой
• защитное покрытие жести
• менделеев его назначил 60-м
• мягкий и легкий металл
• предшественник сурьмы в таблице
• металл для ложек и солдатиков
• преемник индия в таблице
• в таблице он после индия
• менделеев его определил шестидесятым по счету
• вслед за индием в таблице
• металл номер шестьдесят
• металл в основе фольги
• Менделеев его назначил шестидесятым
• шестидесятая графа Менделеева
• металл Свадьбы роз
• Менделеев его назначил шестидесятым по счету
• металл в составе пьютера
• химический элемент для солдатиков
• предтеча сурьмы в таблице
• в таблице он перед сурьмой
• перед сурьмой в таблице
• металл, пригодный для пайки
• между индием и сурьмой в таблице
• идущий следом за индием в таблице
• металл для солдатика
• металл, погубивший Скотта
• материал для мундирных пуговиц
• пятидесятый металл в таблице
• до сурьмы в таблице
• основа медали за четвертое место для участников чемпионата США по фигурному катанию
• последыш индия в таблице
• материал для солдатиков
• после индия в таблице
• металл с символом Sn
• металл игрушечных солдатиков
• химический элемент под названием Sn
• химический элемент под номером пятьдесят
• последователь индия в таблице
• Химический элемент, мягкий ковкий серебристо-белый металл
• Наименование химического элемента
• из какого металла делают «белую жесть»
• из чего делают «белую жесть»
• касситерит это чья руда
• латинское название этого металла переводится, как «твердый», хотя он один из самых мягких и легкоплавких
• менделеев его назначил 60-м в таблице
• металл, «болеющий чумой»
• переведите с латинского слово «станнум»
• по-латински «Stannum» (станнум)
• смесь солей этого металла — «желтая композиция» — издавна использовалась как краситель для шерсти
• ср. крушец (металл) пепельно-серебристый, белее свинца, весьма мягкий, легкоплавкий, легкий весом, более прочих удобный для паянья и для отливки простых мелких вешиц; стар. свинец, откуда пословица: Слово олово, веско. Лить олово, святочное гаданье. Только у молодца и золотца, что пуговка оловца! Оловянная кружка или оловянка ж. и оловяник м. Оловянная руда, колчедан, припой. Оловяничник, оловянщик м. отливающий, работающий оловянную посуду. Оловолей, оловолитель м. церк. оловогадатель, отливающий олово в воду, для гаданья, предсказаний. Оловянные глаза, мутные и бездушные; оловянный глаз, с бельмом. Оловок м. зап. карандаш
Что такое «Оловянная чума», и Действительно ли она погубила великую армию Наполеона
Получайте на почту один раз в сутки одну самую читаемую статью. Присоединяйтесь к нам в Facebook и ВКонтакте.
Однако в средневековье объяснения этому явлению люди не могли найти, да и встречались с ним только жители северных стран, поэтому знали о загадочной «болезни» тогда не все. Только этим можно объяснить то, что на протяжении многих сотен лет олово продолжали массово использовать, хотя это и приводило порой к неприятным ситуациям и даже трагедиям. Так, например, буквально «обратился в прах» огромный груз оловянных слитков, отправленный из Голландии в Россию в конце XIX века. По этому поводу даже проводили полицейское расследование, ведь огромный железнодорожный состав, груженый достаточно дорогим металлом стоил немало, а при вскрытии вагонов там нашли лишь серую пыль.
В 1912 году мужественные полярники покорили свою цель, но оказались не первыми – норвежцы обогнали их на месяц. Экспедиция начала долгий путь домой, но, добираясь до «схронов», измученные люди все чаще обнаруживали канистры с топливом пустыми. Наиболее правдоподобной причиной этого несчастья современные историки считают «оловянную чуму». Пайку швов в то время все еще делали из этого ненадежного металла, и, скорее всего, в условиях полярных морозов канистры дали течь. Кстати, команда Амундсена тоже страдала от этого явления, но их экспедиция была лучше организована, и потеря некоторой части керосина не стала критичной. А вот для англичан все закончилось плохо. Нехватка топлива стала для них настоящей катастрофой, и в марте 1912 года мужественные полярники погибли, не сумев преодолеть обратный путь от покоренного ими полюса.
Понравилась статья? Тогда поддержи нас, жми:
Что такое оловянная чума и почему она заразна
Оловянная чума – довольно опасная штука, из-за которой даже гибли люди и, говорят, потерпел поражение Наполеон
Олово относится к группе лёгких металлов. При нормальных условиях это пластичный, ковкий и легкоплавкий блестящий металл серебристого цвета. Известны также четыре аллотропические модификации олова: ниже +13,2 градусов — α-олово (серое олово) с кубической решёткой типа алмаза, выше +13,2 градусов — β-олово (белое олово) с тетрагональной кристаллической решёткой, а при высоких давлениях — γ-олово и σ-олово.
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления новой кристаллической фазы. Совокупность этих явлений и называется оловянной чумой – это название придумали в 1911 году, хотя явление было известно ещё в античности, когда люди стали замечать, что если переохладить оловянную посуду, то она рассыпется в порошок.
Причём если коснуться покрывшейся пятнами, но ещё не рассыпавшейся охлаждённой оловянной кружкой к другой такой же, то она точно так же покрывалась пятнами и рассыпалась. Понять суть явления удалось гораздо позже, когда на помощь учёным пришёл рентген. Оловянная чума погубила многие музейные экспонаты, за что её также прозвали музейной болезнью. Олово можно «вылечить», добавив в него стабилизатор – например, висмут.
«Оловянная чума» прошлого, от которой пострадало немало людей
Принято считать, что олово было известно человечеству еще в первом тысячелетии до нашей эры. О его удивительных свойствах во все времена слагались легенды, объяснить которые ученые смогли лишь в XX веке, когда стали использовать для изучения свойств металлов рентгеновский анализ. Издревле люди замечали, что изделия из олова, например посуда, на холоде вдруг начинали «заболевать»: покрывались пятнами, а потом и «язвами», которые, разрастаясь, превращали вещь в серый порошок. Если «простудившийся» оловянный предмет прислоняли к «здоровому», тот тоже начинал «болеть». Вот так родилось понятие под названием «оловянная чума», от которой порою страдали не только сами вещи, но и люди.
Много позже ученые выяснили, что при температуре ниже 13 градусов по Цельсию олово из пластичного металла белого цвета постепенно превращается в «грязный» порошок. Новая его модификация, о чем исследователям «рассказал» рентгеновский анализ, имеет кристаллическую решетку, в которой атомы связаны менее плотно. Чем ниже температура воздуха, тем «оловянная чума» протекает интенсивнее и быстрее, достигая максимальной скорости при 33 градусах мороза.
Считается, что «оловянная чума» немало поспособствовала гибели британской экспедиции «Терра Нова» под руководством Роберта Скотта, организованной в 1911-1912 годах к Южному полюсу. Продвигаясь по антарктическим льдам к своей цели, полярники оставляли склады с запасами продовольствия и керосина. На обратном пути команда обнаружила, что емкости с горючим пусты, поскольку они были запаяны оловом, а его поразило загадочное разрушение. Без керосина же измученные члены экспедиции не могли согреться и приготовить себе горячую пищу…
Еще более впечатляет легенда о том, что и армия Наполеона Бонапарта потерпела в России полное поражение, оттого что на мундирах солдат и офицеров были оловянные пуговицы. Конечно, данное обстоятельство не могло сыграть решающую роль в трагедии французов, но ощутимо увеличило страдания и потери наполеоновской армии во время отступления при сильных российских морозах. Эту легенду очень любят рассказывать в университетах преподаватели химии, хотя у нее, как считают историки, есть немало слабых мест. Например, неоспоримым является факт, что к тому времени «оловянная чума» была хорошо известна в северных странах Европы и не учесть этого великий стратег Наполеон просто не мог. Но, с другой стороны, он многого не предвидел, а иначе просто не пошел бы на Россию. Так что, как говорится, дыма без огня не бывает.
Многочисленные легенды о «коварстве» металла подтверждают задокументированные случаи. Так, в конце XIX века из Голландии в Москву отправилось несколько вагонов с оловянными слитками. Но по прибытии в Россию вместо брусков белого металла в вагонах оказался лишь серый, ни на что не годный порошок. Или еще такой факт: в начале XX столетия вокруг военных складов Санкт-Петербурга разгорелся настоящий скандал, когда в ходе ревизии выяснилось, что на всех формах и мундирах нет пуговиц. Складских работников даже хотели отдать под суд, но экспертиза странного серого порошка на одежде подтвердила, что это и есть олово, из которого были изготовлены пуговицы, – опять поработала «оловянная чума».
В конце концов человечество справилось с этим «недугом» металла. Попробуйте сегодня найти изделие из чистого олова – у вас ничего не получится. И даже оловянный припой содержит примеси других металлов, которые легко предотвращают эту удивительную метаморфозу, свойственную только олову. Самым стойким сплавом считается пьютер, который состоит из 93 процентов олова, 2 процентов меди и 5 – сурьмы. Из пьютера изготавливают предметы быта, посуду, украшения и так далее. И даже знаменитые оскаровские статуэтки и «Кубок Америки» отлиты из пьютера и только потом покрыты серебром и золотом. Вот так была побеждена предательская «оловянная чума»»…
И не слова о причинах, ради этого только читал и такой облом.
Самое главное забыли написать:
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм, c = 0,3175 нм, Z = 4. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn равна 7,228 г/см3. При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов[8].
При охлаждении белое олово переходит в α-модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм, Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения[9].
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s2p2-состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10−6 (при 303 К), при температуре плавления становится диамагнитным, χ = −5,1·10−6. Серое олово диамагнитно, χ = −3,7·10−5 (при 293 К).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Нестойкий оловянный припой. О чуме, погубившей Роберта Скотта, и о других заразных болезнях
«Моей вдове»
Это знаменитое письмо написал в Антарктиде замерзающий Роберт Скотт в конце марта 1912 года. 17 января 1912 года, в ходе второй антарктической экспедиции под названием «Терра Нова», Скотту и горстке его соратников (Эдгару Эвансу, Лоуренсу Отсу, Эдварду Уилсону и Генри Боуэрсу) удалось достичь Южного Полюса, где они обнаружили норвежский флаг и множество собачьих следов (14 декабря 1911 года к полюсу пришла группа Руаля Амундсена, в которой кроме Амундсена были Оскар Вистинг, Хелмер Хансен, Сверре Хассель, Олаф Бьяланд).
Соперничество Амундсена и Скотта, фамилии которых теперь навечно сцеплены дефисом в названии американской антарктической станции «Амундсен-Скотт» прямо на Южном Полюсе — это редкостной выразительности пример, демонстрирующий сокрушительную победу эффективного менеджера над прекраснодушным героем. Амундсен (которого завистники звали «Рекламундсен») продумал свою экспедицию до таких мелочей как закупка варежек. Его палатки не продувались, так как были оснащены ультрасовременными застежками-молниями (которые, кстати, на антарктическом морозе иногда так замерзали, что из палатки было невозможно выбраться без ножа, либо молнию приходилось отогревать снаружи). Расходуя груз и провиант, Амундсен методично расстреливал ездовых собак, оставляя ровно столько, сколько нужно было, чтобы тащить полегчавшие сани, скармливая убитых собак живым. Он называл ледники в честь своих спонсоров и за всю экспедицию не потерял ни одного человека.
Скотт при движении на юг также оставлял «базовые лагеря» с топливом и провиантом для обратного пути. Были там и запасы керосина в канистрах, запаянных оловом. На свою беду полярники не учли феномена оловянной чумы.
Аллотропия
Для химических элементов характерны так называемые «аллотропные изменения» (модификации). В зависимости от условий окружающей среды физические свойства элемента, а также его наблюдаемое состояние, могут сильно меняться. Это связано с переупорядочиванием атомов и, следовательно, с изменением силы связей между ними.
Рассмотрим три характерных примера аллотропной модификации:
Озон и кислород
Обе этих молекулы состоят из атомов кислорода, но плотность озона в 1,5 раза больше, чем у кислорода, и химическая активность также выше. Например, возможна прямая реакция озона с серебром, которая между кислородом и серебром происходить не будет:
Кислород жизненно необходим для человека, а озон в больших концентрациях вреден, хотя, в малых полезен. Озон обладает сильным приятным запахом, а кислород нет.
Графит и алмаз
Как известно, алмаз имеет максимальную твердость по шкале Мооса (10), а графит минимальную (1). Из иллюстрации понятно, что связи между атомами углерода в горизонтальных слоях графита остаются сильными, а в вертикальном разрезе очень слабые, благодаря чему графит снимается послойно, и им удобно писать.
Белый и красный фосфор

Температура плавления красного фосфора составляет 600 °C, тогда как температура плавления белого – всего 44 °C. При этом красный фосфор не воспламеняется до 250 °C, а белый фосфор воспламеняется уже при 45 °C, а при трении – и при более низких температурах.
Таким образом, поразительные отличия разных аллотропных модификаций у фосфора и углерода связаны с тем, что кристаллическая решетка этих элементов может упорядочиваться принципиально разным образом. Фосфор и углерод находятся в центральной части своих периодов в таблице Менделеева, однако являются полноценными неметаллами, будучи расположены в правом верхнем углу таблицы, где сосредоточены элементы с неметаллическими свойствами:
Здесь желтым цветом обозначены неметаллы, зеленым – переходные металлы, розово-желтым – полуметаллы. И также есть олово, которое, в отличие от сурьмы и германия, правильнее считать полноценным металлом. Но оно находится на три периода ниже углерода, поэтому тоже проявляет ярко выраженные аллотропные свойства.
Оловянная чума
Наиболее опасной чертой такой аллотропной модификации олова является заразность. Серое олово при контакте превращает белое олово в серое, если температура остается достаточно низкой. Так, принесенная с мороза оловянная миска, поставленная в шкаф в неотапливаемом помещении, может заразить всю остальную оловянную посуду.
Очень странно, что Роберт Скотт не учел этого обстоятельства – ведь оловянная чума известна давно; есть даже предположение, что именно из-за оловянной чумы, поразившей пуговицы наполеоновской армии в ходе отступления из Москвы, французы оказались в особенно незавидном положении.
Оказывается, что оловянная чума характерна только для химически чистого олова, для защиты от нее достаточно правильно подобрать сплав на основе олова. Например, в наше время широко известен сплав пьютер, предметы из которого были найдены даже в раскопках древнеегипетского культурного слоя. Наиболее качественный пьютер состоит из 95% олова, 2% меди и 3% сурьмы. Именно из такого сплава выполнена статуэтка «Оскар».
Поразительно, но в недавнем прошлом для оловянной чумы нашлось практическое применение, связанное с очисткой лабораторной и промышленной оптики от капелек олова. Капельки чистейшего олова используются в качестве мишеней для плазмы, которая применяется для получения глубокого ультрафиолета, а глубокий ультрафиолет – для вытравливания микросхем. При этом для сборки ультрафиолета в действующий луч используется тончайшая оптика, которая быстро тускнеет, так как на ней конденсируется олово. Оказалось, что именно обработка оптики серым оловом позволяет полностью очистить стекло, не оставив на нем ни малейших царапин. В результате срок службы такого собирающего зеркала значительно увеличивается.
Но оловянная чума – лишь наиболее известная аллотропная болезнь металла. Есть и значительно более экзотические и не менее опасные метаморфозы, о которых я также хочу здесь рассказать.
Цинковая чума
Это явление во многом подобно оловянной чуме и изучено гораздо хуже. Впервые описано примерно в 1920-е годы в среде мастеров и коллекционеров, увлекающихся миниатюрными моделями машин. В чистом виде цинк в производстве практически не используется, а в промышленности применяется как основа сплава «цамак», содержащего также алюминий, магний и медь. Цамак был разработан в США в 1929 году, в СССР и России более употребительно название «ЦАМ» (цинк, алюминий, медь). Правильное соотношение металлов в ЦАМ: цинк 95%, алюминий 4%, медь 1%.
Чума, подобная оловянной, поражает такой сплав не просто при изменении физических условий, но и, по-видимому, неизбежно, если доли металлов в ЦАМ отмерены неправильно. Цинковая чума начинается с характерных вздутий на поверхности металла.
Затем микроструктурные изменения проникают в глубину металла, и он крошится.
Прямая аналогия таких повреждений с оловянной чумой не доказана, хотя, по данным частных экспериментов, прочность металлических моделей после замораживания действительно падает в разы. Согласно другой версии (изложенной здесь, где показаны фотографии с последовательной деградацией модели), ЦАМ заболевает чумой, если в его составе оказывается хотя бы минимальное количество олова или свинца. Если бы эта версия подтвердилась, то означала бы, что оловянная чума заразна даже для цинка, являющегося переходным металлом.
Чаще цинковую чуму связывают с технологическим браком при производстве. Например, в сплаве может быть слишком велика доля алюминия, как в китайских моделях, либо в него могут попадать примеси никеля или сурьмы. То есть, такой сплав уже нельзя считать ЦАМ.
До недавнего времени цинковая чума считалась неизлечимой. Действительно, вздутия на моделях практически необратимы, но болезнь можно затормозить, заливая микротрещины эпоксидной смолой. До сих пор неизвестно, является ли цинковая чума физико-химическим заболеванием или просто заводским браком, поэтому мне были бы интересны подробные исследования или новости на эту тему, если Хабр их подскажет.
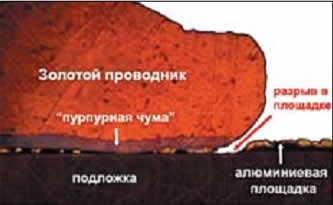
Пурпурная чума
Такое название получила еще одна болезнь металлов, заражение золота алюминием. Проблема была обнаружена в 1970-е годы в США, когда в радиолокационном оборудовании стали применяться СВЧ-транзисторы с алюминиевыми проводниками. При прохождении сильного тока алюминий разогревался, затем, остывая, сжимался, проводник деформировался, транзистор выходил из строя. Чтобы справиться с этой проблемой, проводники стали делать из золота, но подложка транзистора могла по-прежнему содержать алюминий. Тогда оказалось, что при сильном нагревании на стыке золота и алюминия между ними образуется сразу несколько интерметаллических соединений, одно другого пагубнее.
Основной недостаток таких сплавов – хрупкость и низкая прочность. Контакт просто отламывается от транзистора. Наиболее распространенное соединение золота и алюминия – AuAl2, где золото составляет по массе примерно 78,5%, а алюминий – 21,5%. Это соединение имеет яркий фиолетовый цвет, почему и получило название «пурпурная чума».
Пурпурная чума возникает при температурах свыше 1000 °C, то есть, близко к температуре плавления золота (1064 °C). Пурпурная чума образуется неравномерно, поэтому конструкция долго сохраняет механическую плотность, пока не станет слишком поздно. Но уже при остывании до 624 °C пурпурная чума сменяется коричневой, гораздо более хрупким соединением Au2Al. А при температурах 100 °C и ниже начинается диффузия: слои с содержанием алюминия начинают проникать вглубь золота, и пурпурная чума охватывает весь образец, а не только стык (это явление называется «эффект Киркендалла»). При этом уменьшается общий объем вещества, и разрушительное воздействие пурпурной чумы становится фатальным.
Опять же, эта болезнь устраняется достаточно легко: проводник нужно легировать, достаточно 1% платины или палладия.
Интересно, что и пурпурная чума нашла своих ценителей. Соединения золота и алюминия эстетично выглядят, а интерметаллид AuAl2 даже был получен ювелирами в 1930 году и запатентован под названием «аметистовое золото». Уже тогда было замечено, что этот сплав очень хрупкий, поэтому его нельзя ковать или вытягивать, но можно осторожно гранить и оправлять как драгоценные камни. Открыв пурпурную чуму, ювелиры продолжили эксперименты, легируя золото, в частности, галлием и индием. Получались сплавы, близкие по свойствам к золоту, но тяготеющие по цвету к синей части спектра, также очень красивые.
Вместо заключения
Процессы, рассмотренные в статье, можно считать специфическими случаями коррозии. Пример истинной коррозии, напоминающий «металлическую чуму» — это образование дикой патины. В отличие от ровной и плотной благородной патины, которая возникает при медленном окислении меди на воздухе, дикая патина является рыхлой, поэтому не только разрушается вместе с поверхностным слоем медного изделия, но и проникает внутрь него, заражая металл ионами хлора. В Санкт-Петербурге, где атмосфера в конце XX века стала гораздо агрессивнее из-за выхлопных газов, усугубивших высокую влажность, дикая патина серьезно поразила скульптуры «Укрощение коня» на Аничковом Мосту.
Чтобы продлить жизнь этих скульптур, их пришлось искусственно покрывать очень тонким слоем закиси меди, имитирующей благородную патину. Возможно, она позволит продлить жизнь этим красавцам.