disodium metasilicate что это
Метасиликат натрия
| Метасиликат натрия | |
|---|---|
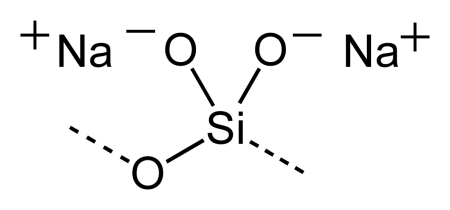 | |
| Систематическое наименование | Метасиликат натрия; силикат натрия |
| Традиционные названия | Кремнекислый натрий |
| Хим. формула | Na2SiO3 |
| Состояние | бесцветные или белые кристаллы |
| Молярная масса | 122,06 г/моль |
| Плотность | 2,4; 2,61 г/см³ |
| Т. плав. | 1088; 1089 °C |
| Энтальпия образования | −1535 кДж/моль |
| Растворимость в воде | 18,8 20 ; 92,3 90 г/100 мл |
| Показатель преломления | 1,52 |
| ГОСТ | ГОСТ 13079-93 |
| Рег. номер CAS | 6834-92-0 |
| PubChem | 23266 |
| Рег. номер EINECS | 229-912-9 |
| SMILES | |
| Рег. номер EC | 229-912-9 |
| RTECS | VV9275000 |
| ChEBI | 60720 |
| Номер ООН | 3253 |
| ChemSpider | 21758 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метасиликат натрия — неорганическое соединение, соль щелочного металла натрия и метакремниевой кислоты с формулой Na2SiO3, бесцветные или белые кристаллы, растворяется в холодной воде, образует кристаллогидрат.
Содержание
Получение
Физические свойства
Метасиликат натрия образует бесцветные или белые кристаллы ромбической сингонии, пространственная группа C cm2, параметры ячейки a = 0,6078 нм, b = 1,053 нм, c = 0,4825 нм, Z = 4.
Хорошо растворим в холодной воде, концентрированные растворы образуют коллоидный раствор «жидкое стекло» гидрозоля SiO2•n H2O.
Из водных растворов выделяется кристаллогидрат Na2SiO3•9H2O, который плавится при 47°С в собственной кристаллизационной воде и начинает разлагаться при температуре выше 100°С.
Разлагается в горячей воде.
Водные растворы имеют щелочную реакцию из-за гидролиза по аниону.
Натрия метасиликат
| Синонимы | динатрия метасиликат, натрий кремнекислый мета, натриевая соль метакремневой кислоты |
| Международное название | sodium metasilicate |
| CAS № | 10213-79-3 |
| ТУ | импорт, 6-18-161-82, 2145-001-52257004-2002 |
| Марка / Сорт | 9-ти водный, 5-ти водный, безводный |
| Упаковка | Мешок 25 кг, 35 кг |
| Химическая формула | Na2SiO3 * 9H2O Na2SiO3 * 5H2O Na2SiO3 |
| Класс опасности груза по ДОПОГ (ООН) | 9.1 (9-ти водный), 8 (5-ти и безводный) |
Склады отгрузки продукции
9-ти водный метасиликат натрия
| Наименование показателя | Норма по ТУ 6-18-161-82 |
| Внешний вид | Мелкокристаллический порошок белого цвета |
| Массовая доля двуокиси кремния (SiO2), %, не менее | 19,0 |
| Массовая доля общей щелочности в пересчете на Na2O, %, не менее | 20,5 |
| Массовая доля полуторных окислов, %, не более | 0,2 |
| Массовая доля общей влаги, %, не более | 59,0 |
5-ти водный метасиликат натрия
Безводный метасиликат натрия
Требования безопасности
| Класс опасности по степени воздействия на организм человека | 2 |
| Виды опасности | |
| Взрыво- и пожароопасность | Пожаро- и взрывобезопасен |
| Опасность для человека | При попадании на влажную кожу, слизистые оболочки и особенно глаза вызывает химические ожоги. Вдыхание метасиликата натрия вызывает изменения в легких – силикоз. При пожаре возможны ожоги. |
Метасиликат натрия – мелкокристаллический порошок белого цвета, представляет собой натриевую соль метакремниевой кислоты и является гидратированным щелочным силикатом натрия.
Метасиликат натрия используется:
— в производстве бытовых и технических моющих, отбеливающих и чистящих средств;
— в нефтедобывающей промышленности;
— в качестве коагулянта для выпуска регенерирующих масел в процессе нефтепереработки;
— в текстильной промышленности для отбеливания;
— в металлургической и машиностроительной промышленности в процессе нейтрализации поверхности металла;
— в пищевой промышленности в процессе рафинации растительного масла;
— в водной обработке в качестве коррозионного ингибитора и второстепенного коагулянта; в быту и на производстве для дезинфекции помещений, белья, посуды, сантехники;
— в производстве охлаждающих жидкостей для двигателей;
— в строительной и дорожно-строительной отраслях.
Безналичный расчёт (выставление счёта на оплату).
Наличными при получении на складе ХИМПЭК в Московской области.
Доставка автотранспортом или железнодорожным транспортом по России и в близлежащие страны.
Самовывоз со склада ХИМПЭК в Московской области.
Минимальный объём заказа:
Мешок 25 кг, 35 кг
Минимальная сумма заказа:
Мешок 25 кг на 2 000 рублей
Натрий метасиликат — понятие, свойства, интересные факты
Натрий метасиликат — неорганическое соединение, натриевая 
Информация о растворимых натриевых стеклах встречается уже в XVI веке в трудах алхимиков, но химически грамотный анализ реактива и способ его производства был разработан в Германии в начале ХХ века. В 1828 году был построен первый завод по изготовлению растворимого силикатного стекла.
Белый порошок с бесцветными кристалликами, без запаха. Технический продукт может быть сероватым или с желтоватым оттенком. Активно поглощает из воздуха влагу и углекислоту. Хорошо растворяется в воде при комнатной температуре, образует кристаллогидраты с пятью и девятью молекулами воды. Разлагается при нагревании и в горячей воде. Вещество не слеживается при хранении, кристаллики механически прочные (не образует пылеобразного порошка).
 |  |
| Натрий метасиликат 5-водный | Натрий метасиликат безводный |
Водный раствор является выраженно щелочным. Реактив взаимодействует с кислотами и щелочами, углекислым газом. Взаимодействие водного раствора с кислотами приводит к выделению гелеобразной кремниевой кислоты. Концентрированные растворы образуют густую жидкость — коллоидный раствор, натриевое жидкое стекло.
— Знаменитая компания Henkel, известная своей бытовой химией, начиналась с завода по изготовлению стирального порошка на основе силиката натрия. Завод был основан в 1876-м году Ф. Хенкелем. До сих пор в стиральных порошках компании Henkel обязательным ингредиентом является силикат натрия.
— Силикаты входят в состав многих камней, 
— Любопытно, что раствор метасиликата натрия в небольшой концентрации — идеальная среда для хранения свежих яиц. В этом растворе их можно хранить более девяти месяцев в нормальных условиях, при комнатной температуре.
— Силикаты натрия часто используют для обработки декораций для театров и киностудий. Пропитанные этим веществом деревянные конструкции практически не горят.
— Всем известный канцелярский клей мгновенного схватывания — это раствор метасиликата натрия.
— Если вам нужно починить дома фарфоровую или стеклянную статуэтку, плафон, декоративную тарелку (не пищевую!) или вазу, воспользуйтесь простым и доступным составом. Смешайте растолченный мел с жидким стеклом (канцелярским клеем) до густоты сметаны и сразу используйте. Смесь быстро застывает и дает прочное соединение. Шов будет белого цвета. Смесью жидкого стекла и цемента можно склеивать камни.
Из следующей статьи вы узнаете о хранении метасиликата натрия, мерах предосторожности при работе с ним, и о сферах его применения.
Силикат натрия, применение в промышленности
Силикат натрия — это натриевая соль кремниевой кислоты. Входит в состав пищевых продуктов в качестве эмульгатора как добавка Е550.
Силикат натрия — распространенное в природе вещество.
Силикат натрия известен под названием жидкое стекло.
Является составной частью различных минералов, почв, полевого шпата.
Химическая формула Na2SiO3.
Виды силикатов натрия:
В лабораторных условиях жидкое стекло было в первый раз получено немецким профессором минералогии и химии Непомуком фон Фуксом в 1818 году.
Химико-физические свойства жидкого стекла
Силикат натрия представляет собой порошок белого цвета, не имеет вкуса и запаха.
Жидкое стекло растворимо в холодной воде, образует густой коллоидный раствор. Водные растворы силиката натрия имеют сильную щелочную реакцию. Выпариванием жидкости из раствора силиката натрия получают твердое аморфное вещество. Из перенасыщенного раствора жидкого стекла получают гидрофильный сорбент — силикагель.
Водный густой раствор силиката натрия имеет свойство при нагревании до трехсот градусов увеличивать свой объем в восемь раз.
Производство силиката натрия
На предприятиях жидкое стекло получают в результате химической реакции гидроксида натрия с диоксидом кремния, которая происходит при температуре в 1000 градусов Цельсия. Другие способы получения жидкого стекла состоят в кристаллизации расплавов из стекол или осаждении из газовой фазы и растворов, содержащих силикат натрия.
Где используется жидкое стекло
Силикат натрия применяют во многих сферах производства:
Силикат натрия используют в лакокрасочном и бумажном производстве. Кроме того, из жидкого стекла делают цемент, бетон, многие строительные смеси.
Силикаты натрия — это не что иное, как водный и втоже время щелочной раствор силикатов натрия или жидкое стекло.
Силикат натрия в стиральном порошке
Натрия силикат является заменителем фосфатов в стиральных порошках и служит для смягчения воды. Он значительно повышает эффективность и качество стирки, препятствует отложению солей на внутренних конструкциях стиральных машин. Силикат натрия — защелачивает раствор и способствует удержанию частиц грязи в растворе во взвешенном состоянии
Силикат натрия входит в состав некоторых стиральных порошков.
Вред силиката натрия
Вредное воздействие силиката натрия мы можем ощутить в двух случаях:
Силикат натрия может вызывать аллергические реакции при употреблении внутрь или при взаимодействии с кожей.
В группе риска люди, склонные к аллергии и маленькие дети. В некоторых странах пищевая добавка Е550 запрещена в продуктах питания.
Вредное воздействие на организм жидкого стекла еще недостаточно изучено.
Чтобы минимизировать возможный вред для здоровья, желательно выбирать продукты питания, стиральные порошки и косметику без силиката натрия.
Для стирки детских вещей рекомендуем использовать детский стиральный порошок без химии.
Метасиликат натрия
| Метасиликат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метасиликат натрия; силикат натрия |
| Традиционные названия | Кремнекислый натрий |
| Химическая формула | Na2SiO3 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные или белые кристаллы |
| Молярная масса | 122,06 г/моль |
| Плотность | 2,4; 2,61 г/см³ |
| Термические свойства | |
| Температура плавления | 1088; 1089 °C |
| Энтальпия образования (ст. усл.) | −1535 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 18,8 20 ; 92,3 90 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,52 |
| Классификация | |
| Рег. номер CAS | 6834-92-0 |
| Рег. номер PubChem | 23266 |
| SMILES | [Na+].[Na+].[O-][Si]([O-])=O |
| Регистрационный номер EC | 229-912-9 |
| RTECS | VV9275000 |
Метасиликат натрия — неорганическое соединение, соль щелочного металла натрия и метакремниевой кислоты с формулой Na2SiO3, бесцветные или белые кристаллы, растворяется в холодной воде, образует кристаллогидрат.
Содержание
Получение
Физические свойства
Метасиликат натрия образует бесцветные или белые кристаллы ромбической сингонии, пространственная группа C cm2, параметры ячейки a = 0,6078 нм, b = 1,053 нм, c = 0,4825 нм, Z = 4.
Хорошо растворим в холодной воде, концентрированные растворы образуют коллоидный раствор «жидкое стекло» гидрозоля SiO2•n H2O.
Из водных растворов выделяется кристаллогидрат Na2SiO3•9H2O, который плавится при 47°С в собственной кристаллизационной воде и начинает разлагаться при температуре выше 100°С.
Разлагается в горячей воде.
Химические свойства
Применение
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Метасиликат натрия» в других словарях:
МЕТАСИЛИКАТ НАТРИЯ — разновидность силикатов натрия … Металлургический словарь
метасиликат натрия — метакремнекислый натрий, кремнекислый натрий … Cловарь химических синонимов I
Метасиликат калия — Общие Систематическое наименование Метасиликат калия; силикат калия Традиционные названия Кремнекислый калий Химическая формула K2SiO3 Физические свойства … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Метасиликат марганца(II) — Общие Систематическое наименование Метасиликат марганца(II) Традиционные названия Кремнекислый марганец Химическая формула MnSiO3 Физические свойства … Википедия
натрия метасиликат — natrio metasilikatas statusas T sritis chemija formulė Na₂SiO₃ atitikmenys: angl. sodium metasilicate rus. натрий метакремнекислый; натрия метасиликат ryšiai: sinonimas – dinatrio trioksosilikatas … Chemijos terminų aiškinamasis žodynas
НАТРИЯ СИЛИКАТЫ — соли к т кремния. Бесцв. кристаллы или стеклообразные в ва. Известны: метасиликат Na2SiO3, ортосиликат Na4SiO4, пиросиликат Na6Si2O7, a также пентаоксодисиликат Na2Si2O5, октаоксотрисиликат Na4Si3O8, гептаоксотрисиликат Na2SiO3, октасиликат… … Химическая энциклопедия
Гексафторосиликат натрия — Общие Систематическое наименование Гексафторосиликат натрия Химическая формула Na2[SiF6] Физические свойства Состояние (ст. усл.) Бесцвет … Википедия
Ортосиликат натрия — Общие Систематическое наименование Ортосиликат калия; силикат калия Традиционные названия Кремнекислый калий Химическая формула Na4SiO4 Физические свойства … Википедия
Гексагидроксоплюмбат(IV) натрия — Общие Систематическое наименование Гексагидроксоплюмбат натрия Химическая формула Na2[Pb(OH)6] Физические свойства Состояние (ст. усл.) … Википедия



